
2.(2007年天津,9)下列关于粒子结构的描述不正确的是 ( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2C12和CCl4均是四面体构型的非极性分子
D.1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值)
1.(2007年上海,2)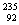 U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关
U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关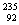 U说法正确的是
(
)
U说法正确的是
(
)
A 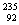 U原子核中含有92个中子 B
U原子核中含有92个中子 B 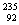 U原子核外有143个电子
U原子核外有143个电子
C 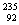 U与
U与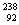 U互为同位素
D
U互为同位素
D 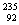 U与
U与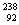 U互为同素异形体
U互为同素异形体
6.A、B、C、D为四种短周期元素,A原子核外仅有1个电子,B、C元素的最高价依次+4、+5,D元素常显-2价,已知B、C、D的原子次外层电子数均为2。
(1)按要求写出:A元素符号 ,B原子结构示意图 ,C单质分子的电子式 。
(2)X、Y、Z、W四种化合物均含上述四种元素,且都属于盐,其中X、Y、Z三种化合物分子式中都只含一个B原子,X和Y的阴离子带一个单位电荷,但X的阴离子比Y阴离子少一个D原子;Z和W的阴离子都带两个单位的负电荷,W中含有两个B原子。
①写出Z、W的化学式,Z为 ,W为 。
②写出Y的溶液与过量NaOH反应的离子方程式 。
[高考题链接]
5.A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A 与C可形成原子个数比分别为1︰1和1︰2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B ,D 。
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
(3)1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐,水及一种气体,写出该反应的化学方程式: 。
(4)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为 。
4.按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A的原子中只有一个能层且只含1 个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;D的原子第三能层上有8个电子,第四能层上只有1个电子;E原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式(至少写出5个):
;
(2)写出用上述元素组成的物质制得A的单质的化学方程式(至少写出2个):
、
;
(3)检验某溶液中是否含有D+的离子,可通过______________反应来实现;检验某溶液中是否含有B-的离子,通常所用的试剂是_________和_________。
(4)写出E的元素符号___________,要证明太阳上是否含有E元素,可采用的方法____________________。
3.下列分子中所有原子都满足最外层8电子结构的是 ( )
A.次氯酸(HClO) B.白磷(P4) C.三氟化硼(BF3) D.三氯化磷(PCl3)
2.下列各原子或离子的电子排列式错误的是 ( )
A. Na+ 1s22s22p6 B. F¯ 1s22s22p6
C . N3+ 1s22s22p6 D. O2¯ 1s22s22p6
1.短周期元素R的原子核外电子数等于核内中子数,该元素单质7.8g与氧气充分反应可生成13g化合物RO,则该元素的价电子层是 ( )
A.1S2 B.2S2 C.3S2 D.4S2
3.用电子式表示物质的形成过程:
HCl ;Na2O2 ;
H2O ;CaCl2 ;
[典型例题]
例1.下列离子中,电子数大于质子数且质子数大于中子数的是 ( )
A.D3O+ B.Li+ C.OD¯ D.OH¯
例2.下列原子或离子核外电子排布不属于基态排布的是 ( )
A.N: 1s22s22p3 B.S2-: 1s22s22p63s23p6
C.Na: 1s22s22p53s2 D.Si: 1s22s22p63s23p2
例3.下列化学式中,能真实表示物质的分子组成的是 ( )
A.CuSO4 B.CS2 C.Ar D.CsCl
例4.有关苯分子中的化学键描述正确的是 ( )
A.每个碳原子的sp2杂化轨道中的其中一个形成大π键
B.每个碳原子的未参加杂化的2p轨道形成大π键
C.碳原子的三个sp2杂化轨道形成三个σ键
D.碳原子的未参加杂化的2p轨道形成σ键
例5.下列各组分子中,都属于含极性键的非极性分子的是 ( )
A. CO2 H2S B. C2H4 CH4 C. C60 C2H4 D.NH3 HCl
[针对性练习]
2.电子式的书写: ;
⑴简单金属阳离子的电子式就是其离子符号;
⑵非金属阴离子的电子式要标 [ ] 及“ 电荷数 ”;
写出电子式:
NaOH Na2O2 NH4Cl
N2 H2 NH3
CH4 H2O2 CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com