
3.1873年上海轮船招商局章程规定:将股份较大之人公举入局作为商董,在主要港口协助商总经营业务。这段材料反映了 ( )
A.洋务民用企业管理权由商董控制
B.近代民族资本主义企业引进西方管理模式
C.洋务民用企业具有近代企业制度的某些雏形
D.洋务民用企业的所需资金全部来自民间资本
2.1870年,一位美国商人来华,这时他享有的特权有 ( )
①可以到安徽黄山观光旅游 ②触犯了中国法律,可以不受中国官员的审判 ③可以到汉口租赁土地
④可以在重庆开设工厂
A.①②③ B. ②③④ C. ①②④ D.①②③④
1.以下图片资料所反映的历史信息最能说明“太平天国是中国民主化进程中偏离轨道的插曲”这一观点的是 ( )

11.(12分)
(1)羟基 醛基 2分 C9H10O2 2分
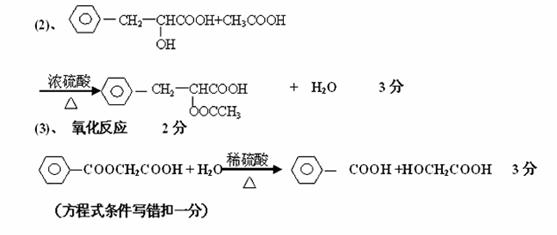

11.(12分)某有机物A(只含C、H、O).其蒸汽密度是相同状况下氢气密度的83倍。16.6gA与足量Na反应生成2 24LH(标准状况下)。A的分子构可表示为:

己知①A分子中碳原子总数是氧原子总数的3倍
②.A与NaHCO3溶液作用,产生无色气泡
③A在一定条件下与乙酸发生酯化反应
请回答相关问题:
(1)A中官能团的名称: ;A的分子式 。
(2)A在-定条件下与乙酸发生酯化反应的化学方程式: 。
(3)A的-种同分异构体B(含苯环)可发生如图的转化关系:
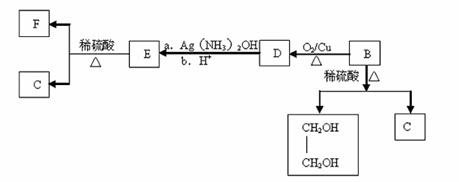
①B→D的反应类型: 。
②E→C+F的化学方程式 。
33.(3)D(2分)
(4)3%(2分);100/27 L2·mol-2(单位写与不写都可以)(2分);减小(1分)
(5)A、D(2分)
10.(14分)
(1)减小(1分); 减小 (1分)
(2)<(1分);当0.5mol N2和1.5mol H2完全反应时,才能放出46.2kJ的热量,但此反应不
能进行到底,所以放热小于46.2kJ。(2分)(其它合理答案也给分)
10. (14分)合成氨工业的核心反应是:
(14分)合成氨工业的核心反应是:
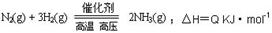
能量变化如右图,回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和
E2的变化是:E1_▲_,E2_▲_(填“增大”、“减小”、“不变”)
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量_▲_(填“<”、“>”或“=”)46.2kJ,理由是_▲_;
(3)关于该反应的下列说法中,正确的是_▲_。
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S>0 D.△H<0,△S<0
(4)将一定量的N2(g)和H2(g)放入1L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol。计算该条件下达到平衡时H2转
化为NH3的转化率_▲_,该温度下的平衡常数K值_▲_。若升高温度,K值变化
_▲_(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是_▲_(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨
9、(15分)食盐是日常生活的必需品,也是重要的化工原料。
⑴粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 四氯化碳
⑴①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 (只填化学式)。
②为了检验NaCl晶体表面是否附带有KCl,可以选择的方法为 。
⑵用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有的玻璃仪器 (填仪器名称)。
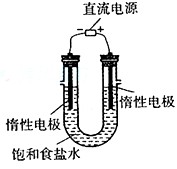
⑶电解饱和食盐水的装置如图所示,在一定的条件下,若收集的H2为2L,则同样条件下收集的Cl2 (填“>”、“=”或“<”)2L,原因是 。
 ⑷实验室制备H2和Cl2通常采用下列反应:
⑷实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4(稀)====ZnSO4+H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
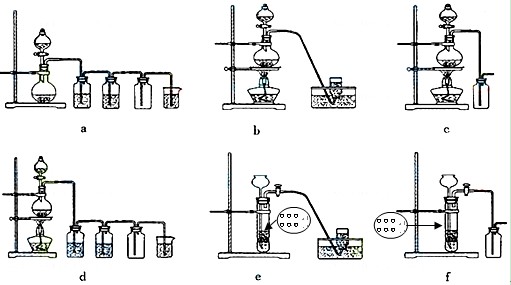
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:


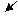

9答案.⑴①BaCl2、NaOH、Na2CO3(错选或多选本小题不得分。NaOH溶液的加入顺序及是否答NaOH不影响得分);(3分) ②透过蓝色钴玻璃观测到焰色为淡紫色证明有氯化钾存在。(2分)
⑵烧杯、500mL容量瓶(规格不写出,扣1分)、胶头滴管;(2分)
⑶< (2分)电解生成的氯气与电解生成的NaOH发生了反应(2分) ;
⑷e (2分) d(2分)
8.(16分)(每空2分)
(1)A 不可能是de
(2)则X可能为ab
(3)B的化学式为FeC13 C理由是2Fe3++Fe=3Fe3+
(4)X的化学式可能为NaOH或HC1
①A13++3OH-=A1(OH)3↓或A1O2+H2O+H+=A1(OH)3↓
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com