
20、2004年被称为天文年,在这一年天文方面有了许多重大发现,其中美国天文学家在星际空间新发现了A、B、C三种星际分子,已知A、B、C的分子量依次为60,58,56,C可看作丙三醇分子内脱去二个水分子的产物, A、B燃烧只生成CO2和H2O。A与葡萄糖混合,只要质量一定,燃烧后生成的CO2和H2O的质量也一定,B与丙炔(C3H4)混合,只要物质的量一定,完全燃烧消耗氧气的量也一定。又知A、B、C均能发生银镜反应,物质的量相同时,与足量银氨溶液作用生成的银的物质的量也相同。1molC可与2molH2发生加成反应。
⑴写出结构简式:A:HOCHCHO ;B:CHCHCHO ;C:CH=CH-CHO。
⑵写出A可能的同分异构体的结构简式:CHCHCHOH ;CHCHOHCH 。
⑶写出与A分子量相等且能与金属钠反应的有机物结构简式:HCOOCH ;CHCOOH 。
|
 |
|
V V V
然后把两个容器中的物质压缩到一个容器中去,而对于2SO2(g)+O2(g) 2SO3(g) ,压缩,平衡右移,故SO2的转化率增大。正确答案为B.
[练习2]在一定温度下,向一个容积固定的密闭真空容器中充入2molX气体,发生反应X(g)
2SO3(g) ,压缩,平衡右移,故SO2的转化率增大。正确答案为B.
[练习2]在一定温度下,向一个容积固定的密闭真空容器中充入2molX气体,发生反应X(g)  Y(g)+Z(g),使反应达到平衡,这时容器中的混合气体中X气体的体积分数是a%. 若在同一容器中,最初放入的是1 molY 和1 molZ 的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中 X 气体所占的体积分数是b% 。则 a
和b 的关系是( )
A. a>b B. a=b C. a<b D. 2a=b (参考答案为A)
Y(g)+Z(g),使反应达到平衡,这时容器中的混合气体中X气体的体积分数是a%. 若在同一容器中,最初放入的是1 molY 和1 molZ 的混合气体,并在相同的温度下使反应达到平衡,这时混合气体中 X 气体所占的体积分数是b% 。则 a
和b 的关系是( )
A. a>b B. a=b C. a<b D. 2a=b (参考答案为A)
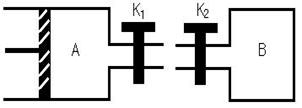 例3.有A、B两只密闭容器,A容器有1个移动的活塞能使容器内保持恒压,B容器能保持恒容,起始时向A容器中充入2molSO2、1molO2,向B容器中充入4moLSO2、2moLO2,并使A和B容器容积都为1L,在保持40℃的条件下,发生2SO2(g)+O2(g)
例3.有A、B两只密闭容器,A容器有1个移动的活塞能使容器内保持恒压,B容器能保持恒容,起始时向A容器中充入2molSO2、1molO2,向B容器中充入4moLSO2、2moLO2,并使A和B容器容积都为1L,在保持40℃的条件下,发生2SO2(g)+O2(g) 2SO3(g),平衡时,A容器的体积为0.8L。填空:
2SO3(g),平衡时,A容器的体积为0.8L。填空:
(1)A容器中SO2的转化率为 ;
(2)A、B两容器中SO2转化率是A B(填“>”、“=”或“<”);
(3)达到平衡时所需时间:A B(填“>”、“=”或“<”);
(4)当A、B两容器连接后,打开K1、K2,一段时间后又重新达到平衡时,A容器的体积为 L。(连通管中气体体积不变)(参考答案:(1)60%;(2)<;(3)<;(4)1.4)
[练习3]体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3(g),并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
这里所说的“相当”即是“等价转化”的意思。
例1.在一个容积固定的密闭容器中,加入m molA, n molB, 发生反应mA(g)+nB(g)  pC(g), 平衡时C的浓度为w mol/L,若容器体积和温度不变,起始时放入a molA, b molB, c molC, 要使平衡后C的浓度仍为w mol/L, 则a、b 、c必须满足的关系是( )
A a:b:c=m:n:p B a:b=m:n ,
pC(g), 平衡时C的浓度为w mol/L,若容器体积和温度不变,起始时放入a molA, b molB, c molC, 要使平衡后C的浓度仍为w mol/L, 则a、b 、c必须满足的关系是( )
A a:b:c=m:n:p B a:b=m:n , 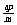 +c=p C
+c=p C  +a=m,
+a=m, 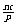 +b=n D a=
+b=n D a=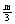 , b=
, b=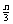 , c=
, c=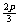 [分析]mA(g) + nB(g)
[分析]mA(g) + nB(g)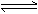 pC(g),
Ⅰ m
mol n mol 0
Ⅱ a
mol b mol cmol
根据等价转化思想:达到相同的平衡状态,则必须起始投料"相当",第Ⅱ次投入c molC,等价于投入
nc/p molB,mc/p molA. 故必须满足:mc/p +a=m,nc/p +b=n。再把上式进行变形,即可得到B 项。故正确答案为B,C.
[练习1]在密闭容器中发生反应2SO2(g)+O2(g)
pC(g),
Ⅰ m
mol n mol 0
Ⅱ a
mol b mol cmol
根据等价转化思想:达到相同的平衡状态,则必须起始投料"相当",第Ⅱ次投入c molC,等价于投入
nc/p molB,mc/p molA. 故必须满足:mc/p +a=m,nc/p +b=n。再把上式进行变形,即可得到B 项。故正确答案为B,C.
[练习1]在密闭容器中发生反应2SO2(g)+O2(g) 2SO3(g), 起始时SO2和O2分别为20mol 和 10mol , 达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为(
)
A 10mol 10% B 20mol 20% C 20mol 40% D 30mol 80%
(参考答案为 B )
2SO3(g), 起始时SO2和O2分别为20mol 和 10mol , 达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为(
)
A 10mol 10% B 20mol 20% C 20mol 40% D 30mol 80%
(参考答案为 B )
21.将6 g的铁粉加入200 mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200 mL0.5mol /LFeSO4溶液和5.2 g固体沉淀物。试计算
(1)反应后生成铜的质量; (2)原Fe2(SO4)3溶液的物质的量浓度。
20.加热10.0g碳酸钠和碳酸氢钠的混合物至质量不在变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数。
19.过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 == 2Na2CO3 + O2 。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置:
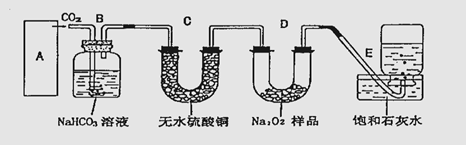
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:

B装置的作用是 ,C装置内可能出现的现象是 。为了检验E中收集到的气体,在取出集气瓶后,用 的木条伸入集气瓶内,木条会出现 。
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因: 。
(3)若D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
。
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (答大或小),相差约 mL(取整数值,所用数据均在标准状况下测定),这是由于___________________________________ _________ 。
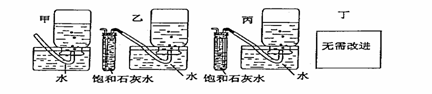 (5)你认为上述A-E的实验装置中,E部分是否安全、合理?E是否需要改为下列四项中的哪一项:
。(用甲、乙、丙、丁回答)
(5)你认为上述A-E的实验装置中,E部分是否安全、合理?E是否需要改为下列四项中的哪一项:
。(用甲、乙、丙、丁回答)
18.铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃。)
17.据媒体报道:社会上曾有不法分子,以黄铜(铜、锌合金)假冒黄金进行诈骗活动。请你设计实验,鉴别黄铜和黄金。
16.已知有以下物质相互转化

试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出用KSCN鉴别G溶液的离子方程式 ;向G溶液加入A的有关离子反应方程式 。
15.明矾是一种 盐。其在水中的电离方程式是 ,明矾的用途 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com