
15.
 竖直面内固定一个内部光滑的圆管,管的半径为r,管内有个直径和管的内径相差不多的小球(看成质点),质量为m,在管内做圆周运动。小球到达最高点时,对管壁的压力大小为3mg,则小球在经过最高点时的速度大小为( )
竖直面内固定一个内部光滑的圆管,管的半径为r,管内有个直径和管的内径相差不多的小球(看成质点),质量为m,在管内做圆周运动。小球到达最高点时,对管壁的压力大小为3mg,则小球在经过最高点时的速度大小为( )
 A.2
A.2 B.
B.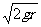 C.
C.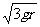 D.
D.
14. 一个物体从某一确定的高度以
一个物体从某一确定的高度以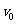 的初速度水平抛出,已知它落地时的速度为
的初速度水平抛出,已知它落地时的速度为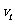 ,整个运动过程的位移为s,则正确的说法是( )
,整个运动过程的位移为s,则正确的说法是( )
 A.它的运动时间是
A.它的运动时间是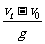 B.它的运动时间是
B.它的运动时间是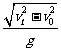
 C.它的位移是
C.它的位移是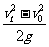 D.它的位移是
D.它的位移是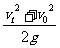
13. 下列说法正确的是( )
下列说法正确的是( )
 A.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
A.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
 B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
B.将SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
 C.由C(石墨)= C(金刚石);△H
= +1.90 kJ·mol
C.由C(石墨)= C(金刚石);△H
= +1.90 kJ·mol 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定
 D.物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,pH大小顺序为①>②>③
D.物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,pH大小顺序为①>②>③
12. 下列关于电化学的说法正确的是( )
下列关于电化学的说法正确的是( )
 A.原电池的负极和电解池阴极放电时都发生氧化反应
A.原电池的负极和电解池阴极放电时都发生氧化反应
 B.铅蓄电池放电时,每消耗0.1 mol Pb,共生成0.2 mol PbSO4
B.铅蓄电池放电时,每消耗0.1 mol Pb,共生成0.2 mol PbSO4
 C.电解精炼铜时,电解池中阴极析出的铜和阳极上溶解的铜一样多
C.电解精炼铜时,电解池中阴极析出的铜和阳极上溶解的铜一样多
 D.将金属a与直流电源的正极相连,而将负极接到废铁上,可防止金属a被腐蚀
D.将金属a与直流电源的正极相连,而将负极接到废铁上,可防止金属a被腐蚀
11. 下列实验设计能够成功的是( )
下列实验设计能够成功的是( )
 A.往2 mL硫酸铜溶液中滴加几滴NaOH稀溶液,振荡,以制备氢氧化铜浊液
A.往2 mL硫酸铜溶液中滴加几滴NaOH稀溶液,振荡,以制备氢氧化铜浊液
 B.往饱和的氯化铁溶液中加入适量的氢氧化钠,再加热至沸腾即可制备氢氧化铁胶体
B.往饱和的氯化铁溶液中加入适量的氢氧化钠,再加热至沸腾即可制备氢氧化铁胶体
 C.分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
C.分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
 D.用石墨作电极,电解Cu(NO3)2、AgNO3的混合溶液,来比较铜和银的还原性强弱
D.用石墨作电极,电解Cu(NO3)2、AgNO3的混合溶液,来比较铜和银的还原性强弱
10. 关于下列各实验和装置图的叙述中,不正确的是( )
关于下列各实验和装置图的叙述中,不正确的是( )
























 A.用图①所示的装置和试剂可制得乙酸乙酯
A.用图①所示的装置和试剂可制得乙酸乙酯
 B.装置②可用于测定气体体积,读数前必须把左右两管液面调平
B.装置②可用于测定气体体积,读数前必须把左右两管液面调平
 C.装置③中X若为四氯化碳,可用于吸收氨气,并能防止倒吸
C.装置③中X若为四氯化碳,可用于吸收氨气,并能防止倒吸
 D.装置④可用于收集H2、CO2、Cl2、HCl、NO2等气体(必要时可添加尾气处理装置)
D.装置④可用于收集H2、CO2、Cl2、HCl、NO2等气体(必要时可添加尾气处理装置)
9. 有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、
 NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如下,结论不正确的是:( )
NO3-、SO42-、Cl-、I-、HCO3-,取该溶液实验如下,结论不正确的是:( )
|
实验步骤 |
实验现象 |
|
①取少量该溶液,加几滴石蕊试剂 |
溶液变成红色 |
|
②取少量该溶液,加Cu片和浓H2SO4,加热 |
有无色气体产生,在空气中又变成红棕色 |
|
③取少量原溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于稀HNO3 |
|
⑤取少量原溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时有部分沉淀溶解 |
A.溶液中肯定存在的离子是Al3+、NO3-、SO4 、Cl-
、Cl-
 B.溶液中肯定不存在的离子是Fe2+、Ba2+、I-、HCO3-
B.溶液中肯定不存在的离子是Fe2+、Ba2+、I-、HCO3-
 C.无法确定溶液中是否含有Na+ 、Cl-
C.无法确定溶液中是否含有Na+ 、Cl-
 D.要确定溶液中是否含Cl-,可取少量原溶液,加入足量Ba(NO3)2溶液后,取
D.要确定溶液中是否含Cl-,可取少量原溶液,加入足量Ba(NO3)2溶液后,取
 上层清液加入AgNO3溶液和稀HNO3
上层清液加入AgNO3溶液和稀HNO3
7. 设NA表示阿伏加德罗常数,下列说法正确的是( )
设NA表示阿伏加德罗常数,下列说法正确的是( )





















 A.9 g SiO2晶体中含有的硅氧键数目为0.3 NA
A.9 g SiO2晶体中含有的硅氧键数目为0.3 NA
 B.28 g乙烯和28 g丙烯中均含有6 NA对共用电子对
B.28 g乙烯和28 g丙烯中均含有6 NA对共用电子对
 C.在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2 NA
C.在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2 NA
 D.标准状况下,22.4 L氖气与22.4 L氟气所含原子数均为2 NA
D.标准状况下,22.4 L氖气与22.4 L氟气所含原子数均为2 NA

|
 A.工业上用电解法冶炼铝: 2Al2O3
(熔融) ==== 4Al+ 3O2↑
A.工业上用电解法冶炼铝: 2Al2O3
(熔融) ==== 4Al+ 3O2↑
 B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
B.适当提高合成氨原料气中N2的含量,可提高H2的转化率
 C.采用离子交换膜法电解饱和食盐水制烧碱,可防止阴极室产生的Cl2进入阳极室
C.采用离子交换膜法电解饱和食盐水制烧碱,可防止阴极室产生的Cl2进入阳极室
 D.制硅酸盐水泥和普通玻璃都要用到石灰石作为原料
D.制硅酸盐水泥和普通玻璃都要用到石灰石作为原料
6. 对下列叙述中的化学知识,分析正确的是( )
对下列叙述中的化学知识,分析正确的是( )
 A.“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂
A.“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是指纤维素和油脂
 B.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
B.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
 C.鸡蛋清中加入氯化铵,会使蛋白质变性
C.鸡蛋清中加入氯化铵,会使蛋白质变性
 D.在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
D.在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
5. 右图曲线显示一个处于安静状态的人在不同气温中,
右图曲线显示一个处于安静状态的人在不同气温中,

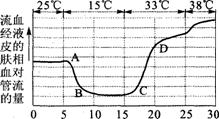 流经皮肤血管的血液相对流量。据此判断,下列叙述
流经皮肤血管的血液相对流量。据此判断,下列叙述
 错误的是( )
错误的是( )
 A.在AB段下丘脑分泌活动加强
A.在AB段下丘脑分泌活动加强
 B.在AB段机体甲状腺激素分泌增加
B.在AB段机体甲状腺激素分泌增加
 C.在D点以后需要及时补充水和无机盐
C.在D点以后需要及时补充水和无机盐
 D.在CD段皮肤血管收缩,汗腺分泌加强
D.在CD段皮肤血管收缩,汗腺分泌加强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com