
4. (08年广东文基·64)铁和铁合金是生活中常用的材料,下列说法正确的是
A.不锈钢是铁合金,只含金属元素
B.一定条件下,铁粉可与水蒸气反应
C.铁与盐酸反应,铁合金不与盐酸反应
D.在空气中,铁板比镀锌铁板更耐腐蚀
答案:B
3. (2007年高考上海化学卷,铝)用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是 ( )


A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
答案 :D
(1)抓价态:从铁元素三种价态的相互转化(铁三角关系)去认识铁及其化合物间的氧化-还原反应规律.
(2)想属类:如铁是一种比较活泼的过渡金属,氧化亚铁、氧化铁为碱性氧化物,氢氧化亚铁、氢氧化铁为不溶性弱碱,氯化铁为强酸弱碱盐,由此去分析理解它们各自所具有的性质.
Fe2+和Fe3+的检验
(1)Fe2+的检验:
方法一:滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色
方法二:滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色。
(2)Fe3+的检验:
方法一:滴加KSCN溶液或NH4SCN溶液,溶液立即变为血红色
方法二:滴加NaOH溶液,出现红褐色沉淀

击破考点一:金属的性质与结构
例1:金属的下列性质中与金属金属晶体结构无关的是 ( )
A.导电性 B.化学反应中易失去电子
C.延展性 D.硬度
答案:B
解析:金属的物理性质主要受金属结构的影响;金属的化学性质主要受金属原子的结构影响。
[变式训练1]有关合金的叙述不正确的是 ( )
A.合金的熔点比它的各成份金属的熔点低
B.合金的硬度和强度一般比纯金属高
C.合金一定是金属熔合而成的物质
D.硬铝、黄铜和钢均为合金
答案:C
击破考点二:镁、铝的性质及计算
例2:某化学兴趣小组用回收的镁铝合金制取氢气。现有l0.8 g镁铝合金,下列说法正确的是( )
A.常温下与足量18mol/LH2SO4溶液反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3溶液反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4溶液反应,放出H2的物质的量在0.45 mol-0.6 mol之间
D.常温下与足量2mol/LNaOH溶液反应,放出H2的物质的量在0-0.6 mol之间
答案:CD
解析:本题考查镁铝的性质。镁与浓硫酸反应生成SO2,铝与浓硫酸钝化,A项错误;镁铝与稀硝酸反应生成NO,B项错误;当10.8g合金完全是镁,产生氢气0.45mol,当10.8g合金完全是铝,产生氢气0.6mol,C项正确;当10.8g合金完全是镁,不产生氢气,当10.8g合金完全是铝,产生氢气0.6mol,D项正确。
[变式训练2]等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2mol.L-1H2SO4溶液 B.18 mol.L-1H2SO4溶液
C.6 mol.L-1KOH溶液 D.3 mol.L-1HNO3溶液
答案:A
解析:镁铝都可与稀硫酸反应放出氢气,但与浓硫酸,铝在常温下发生钝化,镁虽反应但不产生氢气。与氢氧化钾只有铝反应。与硝酸反应,硝酸为强氧化性酸,都不会产生氢气。
[变式训练3]用铝箔包裹2.3 g金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为 ( )
A.O2和H2的混合气体 B.0.1g H2 C.大于0.1g H2 D.小于0.1g H2
答案:C
解析:本题涉及到根据化学反应方程式进行计算问题。根据反应方程式2Na+2H2O==2NaOH+H2↑可知,2.3g金属钠与水作用可产生0.1g H2,而Al还会和反应生成的NaOH作用2Al+2NaOH+2H2O==2NaAlO2+3H2↑,进一步产生H2,故收集到的H2总量要大于0.1g
击破考点三:镁、铝化合物的考查
例3:下列有关金属铝及其化合物的叙述正确的是 ( )
A.铝在常温下不能与氧气反应
B.铝不能与氯气反应
C.铝既能溶于酸,又能溶于碱
D.氧化铝只能与酸反应,不能与碱反应
答案:C
解析:铝为活泼金属,常温下能与O2反应生成致密的氧化膜;加热条件下与Cl2激烈反应;铝、氧化铝既能与酸又能与碱反应。
[变式训练4]下列溶液能与镁反应生成氢气的是 ( )
A.氯化铵溶液 B.氢氧化钠溶液
C.碳酸钾溶液 D.饱和石灰水
答案:A
解析:氯化铵溶液水解呈酸性,所以答案为A.
[变式训练5]将100mL0.6mol/LAlCl3溶液跟0.4mol/LNaOH溶液混合后,得到3.9g氢氧化铝沉淀,此时消耗氢氧化钠的体积是 ( )
A.250mL B.375mL C.475mL D.500mL
答案:BC
解析:得到3.9g氢氧化铝沉淀可能有两种情况,①氢氧化钠量不足,只发生反应:Al3++3 =Al(OH)3 ↓,则V(NaOH)=375mL; ②氢氧化钠过量,与生成的氢氧化铝继续反应,发生的反应为:Al3++3
=Al(OH)3 ↓,则V(NaOH)=375mL; ②氢氧化钠过量,与生成的氢氧化铝继续反应,发生的反应为:Al3++3 =Al(OH)3 ↓ , Al(OH)3+
=Al(OH)3 ↓ , Al(OH)3+ =
= +2H2O,则V(NaOH)=475mL
+2H2O,则V(NaOH)=475mL
击破考点四:考查Fe2+与Fe3+的性质
例4:将过氧化钠投入到氯化亚铁溶液中,可以观察到的现象是 ( )
①生成白色沉淀②生成红裼色沉淀③有气泡产生④溶液变成棕黄色
A.①③ B.①④ C.②③ D.②④
答案:C
[变式训练6]浅绿色的硝酸亚铁溶液中存在如下平衡:Fe2++2H2O Fe(OH)2++2H+,若向该溶液中滴加足量的盐酸,则溶液的颜色
( )
Fe(OH)2++2H+,若向该溶液中滴加足量的盐酸,则溶液的颜色
( )
A.变黄色 B.绿色变深 C.绿色变浅 D.无变化
答案:A
[变式训练7]在氧化铁、氯化铜和盐酸混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是 ( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
答案:C
击破考点五:氢氧化铝的两性及“铝三角”之间的转化
例5:某无色溶液里,只含有下列八种离子中的某几种:Mg2+、Na+、H+、Ag+、 、
、 、
、 、
、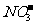 。已知该溶液能跟金属铝反应, 且放出的气体只有氢气试回答:
。已知该溶液能跟金属铝反应, 且放出的气体只有氢气试回答:
(1)若溶液跟Al反应后有 生成, 则原溶液一定含有大量的
离子, 还可能含有大量的
离子。
生成, 则原溶液一定含有大量的
离子, 还可能含有大量的
离子。
(2)若溶液跟Al反应后有Al3+生成, 则原溶液中一定不含有大量 离子
答案:(1)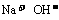
 (2)
(2)
解析:(1)本题考查的基础知识
①单质Al既能与强碱反应又能与强酸(非氧化性酸)皆有H2生成 ②离子共存问题(离子能共存即离子间没有反应发生)
(2)溶液跟Al反应有 生成。
生成。 只存在于碱性溶液中, 上述八种离子组成强碱只能为NaOH
只存在于碱性溶液中, 上述八种离子组成强碱只能为NaOH 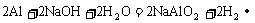 , ∴原溶液中一定含有大量
, ∴原溶液中一定含有大量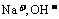 。有OH-存在,
。有OH-存在, 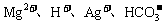 这些离子不能存在, 所以还可能存在离子。
这些离子不能存在, 所以还可能存在离子。
(3)若溶液跟Al反应有Al3+生成。Al3+只存在酸性溶液中, 上述八种离子组成强酸只能为Hcl, HNO3, 但Al与HNO3反应不出H2, 只能 所以原溶液中肯定含有H+, Cl-与H+, Cl-不共存的为
所以原溶液中肯定含有H+, Cl-与H+, Cl-不共存的为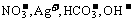 。
。
[变式训练8]粉末状试样A是一种含有少量某钾盐(白色或无色)和一种活泼金属组成的混合物。进行如下实验:
①将A和适量CuO粉末混合均匀,放在一置于三角架的石棉网上,用酒精灯加强热,可看到混合物迅猛燃烧,白光耀眼。完全反应后得到混合物B。
②向冷却的混合物B中加入稀盐酸至沉淀不再溶解,恰好用去HCl 0.6mol,得到溶液C。(设溶液体积为1000mL)和沉淀D,然后过滤。
③将溶液C加强热、蒸干、灼烧,得到固体E,且E的质量和A的质量恰好相等。
④如果向溶液C中逐滴加入NaOH溶液,则会出现白色沉淀且逐渐增多,继续滴加NaOH溶液白色沉淀又会逐渐减少,最后完全消失。请填空:
(1)写出①中可能的三个反应的化学方程式 ; ; 。
(2)A中金属的质量为 ;所含钾盐的物质的量为 。
(3)写出④中先后反应的离子方程式 , 。
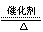
答案:1)2KClO3
 2KCl+3O2↑;2Al+3CuO
2KCl+3O2↑;2Al+3CuO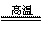 Al2O3+3Cu;4Al+3O2
Al2O3+3Cu;4Al+3O2 2Al2O3;
2Al2O3;
(2)5.4g;0.1mol;
(3)Al3++3OH- = Al(OH)3↓;Al(OH)3+ =
=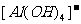
击破考点六:考查氢氧化亚铁的制备方法
例6:用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂, 打开
止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由
是 。
答案:方法一(1)稀H2SO4、铁屑
(2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2
方法二(1)稀H2SO4、铁屑
(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
击破考点七:考查铁的化合物及其计算
例7.在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(S.P.T),此时溶液中无Fe3+。则下列判断正确的是 ( )
A.混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3
B.反应后所得溶液中的Fe2+和Cl-的物质的量之比为1:3
C.混合物中,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物中,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
答案:C
[变式训练9]现有两种金属的混合物共4克,与足量氯气反应后,固体增重7.1克。另取4克该金属混合物,投入到足量盐酸中,产生2.24L(S.T.P)H2.则该混合物的组成不可能是 ( )
A.Cu,Al B.Mg,Fe C.Zn,Al D.Mg,Zn
答案:AB
击破考点八:铝铁及其化合物
例8:将a克Fe2O3、Al2O3样品溶解在过量的200mL Ph=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为( )
A.0.1 mol.L-1 B.0.2 mol.L-1
C.0.4 mol.L-1 D.0.8 mol.L-1
答案:B
解析:由题意及氧化物、氢氧化铝的两性可知,要使Fe3+、Al3+刚好完全沉淀,则须使溶液中的氢离子和氢氧根离子量相等
由题目中反应式可知,溶解1 mol Fe2O3所消耗的氢离子数与沉淀2 mol Fe3+所消耗的氢氧根离子数相等。同理,Al2O3也如此。故只要控制酸中的氢离子数与碱中所含氢氧根离子数相等即可使Fe3+、Al3+刚好完全沉淀。
[变式训练10]向a L物质的量浓度为 的明矾
的明矾 溶液中逐滴加入b L物质的量浓度为
溶液中逐滴加入b L物质的量浓度为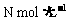 的
的 溶液时,①当b满足________时,沉淀的总物质的量为最大值;当b满足________时,沉淀的总质量为最大值。②当
溶液时,①当b满足________时,沉淀的总物质的量为最大值;当b满足________时,沉淀的总质量为最大值。②当 ,
, 时,生成沉淀的质量为多少克?
时,生成沉淀的质量为多少克?
解析:①根据化学方程式 和
和 可知:向明矾中加
可知:向明矾中加 ,当
,当 沉淀完全时,生成沉淀的物质的量最大,此时
沉淀完全时,生成沉淀的物质的量最大,此时 ,则
,则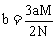 ;当
;当 沉淀完全时,沉淀质量最大,此时
沉淀完全时,沉淀质量最大,此时 ,即
,即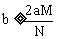 。
。
②根据IV中公式②可得:

击破考点九:铁铜及其化合物
例9:把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是 ( )
A.只有Fe2+ B.只有Fe3+
C.有Fe2+和Cu2+ D.有Fe3+和Cu2+
答案:A
解析:浓硝酸具有强氧化性,热的浓硝酸可将Fe和Cu分别氧化成Fe3+和Cu2+,过量的铁又与Fe3+和Cu2+反应生成Fe2+和Cu,所以充分后,溶液中大量存在的金属阳离子为Fe2+,故选A
[变式训练11]在铁与铜的混和物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,m1与m2的关系是
A. m1一定大于m2 B. m1可能等于m2
C. m1一定等于m2 D. m1可能大于m2
答案:A
[变式训练12]将6g纯铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中充分反应后得到200mL0.5mol/L的FeSO4溶液和5.2g固体,求:
(1)反应后生成铜多少克?
(2)加入铁粉前Fe2(SO4)3物质的量浓度
答案:发生反应的化学方程式为:
①Fe+Fe2(SO4)3=3FeSO4 ②Fe+CuSO4=Cu+FeSO4
两个反应共生成FeSO4为:0.2L×0.5mol/L=0.1mol
观察两个反应不难发现,若生成同样的FeSO4,②式消耗的铁更多。假设0.1molFeSO4全部为②式产生,则此时消耗的铁将达最大量为a。
Fe - FeSO4
1mol 1mol
a 0.1mol
a=0.1mol,即铁为5.6g,则5.2g固体中含Cu也含剩余的Fe,设原溶液的Fe2(SO4)3和CuSO4的物质的量分别为x和y。
Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=Cu+FeSO4
X x 3x y y y y
 由题意得 3x+y=0.1mol
由题意得 3x+y=0.1mol
6g-56g/mol×(x+y)+64g/mol×y=5.2g
解得:x=0.02mol y=0.04mol
则生成铜:0.04mol×64g/mol=2.56g
原Fe2(SO4)3和物质的量浓度为0.02mol/0.2L=0.1mol/L
击破考点十:有关图像问题的考查
例10:向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
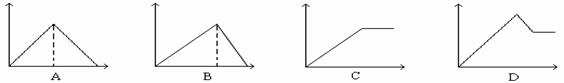
答案:D
解析: Al(OH)3能溶于过量的NaOH溶液,但是Mg(OH)2不溶,因此反应最终的沉淀不为“O”,据此断定A、B皆错。混合液在与NaOH溶液反应过程中,一定有沉淀减少过程[Al(OH)3溶于NaOH溶液中],最终只有Mg(OH)2,所以C错误D正确
[变式训练13]准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100ml某浓度的硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10ml的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图所示。请填空回答:



(1)H2SO4溶液的物质的量浓度为 ;
(2)a=2.3,用于沉淀铁离子,消耗氢氧化钠溶液的体积是
答案:(1)1.75mol/L (2)2.7ml.
解析:(1)由图像可知当加入35mlNaOH溶液时,滤液中过量的硫酸被中和,
且Fe3+、Al3+全部沉淀,用整体法分析反应的过程,消耗H+的物质的量等
于OH+的物质的量,得硫酸的物质的量浓度为:=1.75(mol/L)
(2)用隔离法考查:从溶解Al(OH)3消耗,推知用于Al3+沉淀所消耗的NaOH溶液30ml,则
沉淀Fe3+所消耗的NaOH溶液为:35-30-2.3=2.7ml

1.(2007年高考广东理基,铝)下列有关金属铝及其化合物的叙述正确的是 ( )
A.铝在常温下不能与氧气反应
B.铝不能与氯气反应
C.铝既能溶于酸,又能溶于碱
D.氧化铝只能与酸反应,不能与碱反应
答案: C
2. (2007年高考海南化学卷,镁)下列溶液能与镁反应生成氢气的是 ( )
A.氯化铵溶液 B.氢氧化钠溶液 C.碳酸钾溶液 D.饱和石灰水
答案 :A
I.  与NaOH反应生成沉淀的质量
与NaOH反应生成沉淀的质量
①当 时,
时,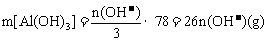 。
。
②当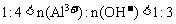 时,
时,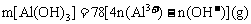 。
。
③当 时,
时, 。
。
II.  与强酸(
与强酸( )反应生成沉淀的质量
)反应生成沉淀的质量
①当 时,
时,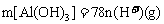 。
。
②当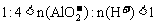 时,
时,
 。
。
③当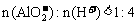 时,
时, 。
。
 III.
III. 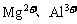 的混合溶液与
的混合溶液与 反应时,求
反应时,求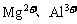 的物质的量。
的物质的量。
若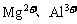 与
与 的反应关系如下图,则
的反应关系如下图,则
①
②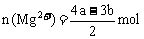
IV. 明矾 溶液与
溶液与 溶液反应生成沉淀的质量。
溶液反应生成沉淀的质量。
①当 时,
时,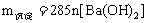 ;
;
②当 时,
时,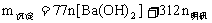 ;
;
③当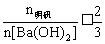 时,
时, 。
。
31. (26分)
(26分)
 Ⅰ.夏季,将一植株放在密闭玻璃罩内,置于室外一昼夜,获得实验结果如下图所示。请回答下列问题:
Ⅰ.夏季,将一植株放在密闭玻璃罩内,置于室外一昼夜,获得实验结果如下图所示。请回答下列问题:

|
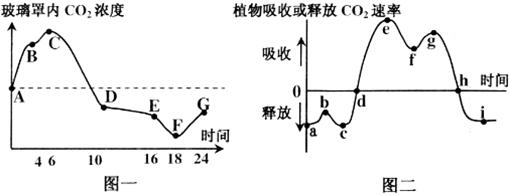
 (1)图二中的b点对应于图一中的________点,导致图二曲线在b点上升可能的原因是___________。
(1)图二中的b点对应于图一中的________点,导致图二曲线在b点上升可能的原因是___________。
 (2)图二中的ef段的C3的含量_____(填“增多”或“减少”),gh段C5的含量____(填“增多”或“减少”)。
(2)图二中的ef段的C3的含量_____(填“增多”或“减少”),gh段C5的含量____(填“增多”或“减少”)。
 (3)到达图二中__________点时,植物体积累的有机物最多。i点时植物形成ATP的途径有____________。
(3)到达图二中__________点时,植物体积累的有机物最多。i点时植物形成ATP的途径有____________。
 (4)经过这一昼夜之后,植物体的有机物含量会___________。(填“增加”、“减少”或“不变”)
(4)经过这一昼夜之后,植物体的有机物含量会___________。(填“增加”、“减少”或“不变”)

 Ⅱ. 为探究血糖调节的影响因素,设计如下实验流程。
Ⅱ. 为探究血糖调节的影响因素,设计如下实验流程。



























 据图回答:
据图回答:
 (1)实验中取
的家兔5只,编号①至⑤。其中①号家兔的作用是
。
(1)实验中取
的家兔5只,编号①至⑤。其中①号家兔的作用是
。
 (2)二次注射后,与⑤号家兔相比,若④号家兔产生尿素的量增加,原因是 (物质)大量分解导致的。
(2)二次注射后,与⑤号家兔相比,若④号家兔产生尿素的量增加,原因是 (物质)大量分解导致的。
 (3)二次注射后,低血糖症状最先得到缓解的是 号家兔:若②号家兔出现糖尿,则该兔的尿量将会 (填“增多”或“减少”),鉴定糖尿的试剂是
。
(3)二次注射后,低血糖症状最先得到缓解的是 号家兔:若②号家兔出现糖尿,则该兔的尿量将会 (填“增多”或“减少”),鉴定糖尿的试剂是
。








 命题人:苏公祥 邹永平 彭颂春
命题人:苏公祥 邹永平 彭颂春
 审题人:吴高文 雷 平 陈 渝
审题人:吴高文 雷 平 陈 渝













 重庆一中高2010级高三上期第一次月考
重庆一中高2010级高三上期第一次月考
30. (16分)
(16分)
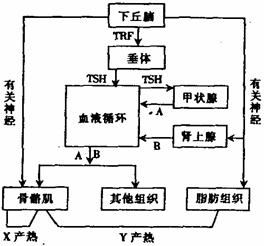
 Ⅰ.根据人体调节产热的主要途径示意图回答有关问题。
Ⅰ.根据人体调节产热的主要途径示意图回答有关问题。
 (1)图中TSH是 激素。TSH只能作为甲状腺细胞的信号,该信号的识别与甲状腺细胞膜上具有特定的
(物质)有关。
(1)图中TSH是 激素。TSH只能作为甲状腺细胞的信号,该信号的识别与甲状腺细胞膜上具有特定的
(物质)有关。
 (2)某患者体温调节能力下降,甚至丧失,最可能受损的部位是图中的 。
(2)某患者体温调节能力下降,甚至丧失,最可能受损的部位是图中的 。
 (3)寒冷环境中A和B激素在血液中的含量
(3)寒冷环境中A和B激素在血液中的含量
 (填“上升”或“下降”)。该图所示的人体调节产热的方式是 。
(填“上升”或“下降”)。该图所示的人体调节产热的方式是 。


























 Ⅱ.下图1、图2和图3分别表示甘蔗和大豆的光合速率与CO2浓度的关系,甘蔗和人参的CO2吸收量与光照强度的关系。请据图回答问题:
Ⅱ.下图1、图2和图3分别表示甘蔗和大豆的光合速率与CO2浓度的关系,甘蔗和人参的CO2吸收量与光照强度的关系。请据图回答问题:

 (1)图1中的曲线L1、L2表示的植物分别是
。(填植物名称)
(1)图1中的曲线L1、L2表示的植物分别是
。(填植物名称)
 (2)图2中L1、L2表示的植物分别是 。(填植物名称)
(2)图2中L1、L2表示的植物分别是 。(填植物名称)
 (3)甘蔗和大豆的叶片解剖结构最大的区别是甘蔗
。
(3)甘蔗和大豆的叶片解剖结构最大的区别是甘蔗
。
29. ( 13分)由丙烯经下列反应可得F、G两种高分子化合物,它们都是常用塑料的主要成分。
( 13分)由丙烯经下列反应可得F、G两种高分子化合物,它们都是常用塑料的主要成分。


 (1)聚合物F的结构简式是__________________
,A→B的反应类型为
(1)聚合物F的结构简式是__________________
,A→B的反应类型为
 (2) D的结构简式是___________________________________________
(2) D的结构简式是___________________________________________
 (3) B转化为C的化学方程式是__________________________________________
(3) B转化为C的化学方程式是__________________________________________
 (4) 在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_________________________________________
(4) 在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_________________________________________
 (5) E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol
H2,则该种同分异构体为_______________________________
(5) E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol
H2,则该种同分异构体为_______________________________

28. (15分) A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可
(15分) A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可
 形成原子个数比分别为l∶1和1∶2的两种离子化合物X、Y,A与D的原子序数之和等于B
形成原子个数比分别为l∶1和1∶2的两种离子化合物X、Y,A与D的原子序数之和等于B
 与C的原子序数之和,请回答下列问题:
与C的原子序数之和,请回答下列问题:





















 (1)X的电子式为:
,C的原子结构示意图为
(1)X的电子式为:
,C的原子结构示意图为
 A、B的气态氢化物更稳定的是 (填化学式)
A、B的气态氢化物更稳定的是 (填化学式)
 (2)单质D在CO2中燃烧的化学方程式为
(2)单质D在CO2中燃烧的化学方程式为
 (3) 2 mol C的氢氧化物与2 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式
(3) 2 mol C的氢氧化物与2 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式
 (4)常温下,B、C形成的化合物的水溶液中所有离子的物质的量浓度由大到小的顺为
(4)常温下,B、C形成的化合物的水溶液中所有离子的物质的量浓度由大到小的顺为

27.
 ( 19分)某研究性学习小组的同学用下图所示装置在实验室再现工业生产过程,加热装置已省略。
( 19分)某研究性学习小组的同学用下图所示装置在实验室再现工业生产过程,加热装置已省略。





 A
B
C
D
E F
A
B
C
D
E F
 (I)甲同学用此套装置研究二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,D处盛放V2O5,E处为冰水浴。
(I)甲同学用此套装置研究二氧化硫催化氧化的过程,并制取少量三氧化硫晶体,D处盛放V2O5,E处为冰水浴。
 (1)已知 6.4 g 二氧化硫被氧气氧化成气态三氧化硫,放出 9.83 kJ 热量。反应的热化学方程式为
(1)已知 6.4 g 二氧化硫被氧气氧化成气态三氧化硫,放出 9.83 kJ 热量。反应的热化学方程式为
 (2)A中发生的化学反应方程式为
(2)A中发生的化学反应方程式为
 C装置中盛放的液体药品是
C装置中盛放的液体药品是
 (3)D装置相当于硫酸工业生产中的
(填设备名称)
(3)D装置相当于硫酸工业生产中的
(填设备名称)
 (4)在实验过程中D装置不能持续加热到太高温度的理由是
(4)在实验过程中D装置不能持续加热到太高温度的理由是
 (II)乙同学认为此套装置可用于研究氨催化氧化的过程,D处盛放铂铑合金网,E处冰水冷却的U型管中有红棕色气体X生成且越接近U型管下部颜色越浅。A处没有加热装置。
(II)乙同学认为此套装置可用于研究氨催化氧化的过程,D处盛放铂铑合金网,E处冰水冷却的U型管中有红棕色气体X生成且越接近U型管下部颜色越浅。A处没有加热装置。
 (5)若A中产生的是氨气,则所用试剂为
(5)若A中产生的是氨气,则所用试剂为
 (6)写出D装置中发生的化学反应方程式
(6)写出D装置中发生的化学反应方程式
 (7)为什么此时U型管中的红棕色气体越接近管下部颜色越浅?
(7)为什么此时U型管中的红棕色气体越接近管下部颜色越浅?
26. ( 13分) 甲醇是重要的能源物质。合成甲醇的反应为: CO(g)+2H2(g)
( 13分) 甲醇是重要的能源物质。合成甲醇的反应为: CO(g)+2H2(g) CH3OH(g);△H=Q kJ·mol
CH3OH(g);△H=Q kJ·mol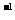 。一定条件下,在某密闭容器中进行上述反应。
。一定条件下,在某密闭容器中进行上述反应。





















 (1)下图1表示CO的反应速率与时间的关系曲线,则t2时改变的一个条件是_________________,上述反应的△H ____ (填>0、<0或无法判断)。
(1)下图1表示CO的反应速率与时间的关系曲线,则t2时改变的一个条件是_________________,上述反应的△H ____ (填>0、<0或无法判断)。

 (2)若起始时充入2 mol CO和4 mol H2,下图2表示该反应在t1时达到平衡,在t3时改变某条件发生变化的曲线。试判断,图2中t3时改变的条件
(2)若起始时充入2 mol CO和4 mol H2,下图2表示该反应在t1时达到平衡,在t3时改变某条件发生变化的曲线。试判断,图2中t3时改变的条件
 是________________________,t1时CO的转化率为 。
是________________________,t1时CO的转化率为 。
 (3)测定甲醇的质量分数时,常先用稀H2SO4酸化的重铬酸钾(K2Cr2O7)溶液氧化甲醇,甲醇被重铬酸钾氧化成CO2和H2O,Cr2O7
(3)测定甲醇的质量分数时,常先用稀H2SO4酸化的重铬酸钾(K2Cr2O7)溶液氧化甲醇,甲醇被重铬酸钾氧化成CO2和H2O,Cr2O7 被还原为Cr3+,该反应的离子方程式为:
,每消耗4 mol H+ 转移 mol 电子。
被还原为Cr3+,该反应的离子方程式为:
,每消耗4 mol H+ 转移 mol 电子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com