
10. (1)上表所列铜化合物中,铜的质量百分含量最高的是Cu2S

11. 某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份溶液中逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增大;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。向另一份溶液中逐滴加入Ba(OH)2溶液,开始现象相同,但最终仍有白色沉淀;过滤,用盐酸处理该沉淀物,经洗涤和干燥,得到白色固体46.6g。请回答下列问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
(3)假设实验过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol/L,请画图表示生成沉淀的物质的量与加入NaOH溶液的的体积关系。

答案:(1)NH4+、Al3+、 (
(
(2)NH4Al(SO4)2·12H2O[或(NH4)2SO4·Al2(SO4)3·24H2O]

10. 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:

回答下列问题:
⑴ 钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。
⑵ 上述生产流程中加入Fe屑的目的是 ,检验副产品甲是否变质的实验方法是 。
⑶ 上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
⑷ 最近,用熔融法直接电解中间产品乙制取金属钛获得成功。写出电解乙制取金属钛的化学方程式 
答案:⑴ FeSO4·7H2O
⑵ 防止Fe2+氧化 取副产品甲少许溶于水,滴加适量KSCN溶液,观察溶液是否变为血红色
⑶ 稀盐酸
 ⑷ TiO2 Ti+O2↑
⑷ TiO2 Ti+O2↑
9. (湖南长沙一中09高三化学第五次月考)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水而氢氧化锌能溶于氨水生成[Zn(NH3)4]2+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示);
(2)写出锌跟氢氧化钠溶液反应的离子方程式 ;
(3)下列各组中的两种溶液,用相互滴加的方法即可鉴别的是
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氨水 ④偏铝酸钠和盐酸 ⑤碳酸氢钠和氢氧化钙
答案:(1)AlO2-;(2)Zn+2 =
=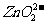 +H2↑ (3)①③④
+H2↑ (3)①③④
8. 下列实验中产生的现象与对应图形(纵坐标n均表示产生的Al(OH)3的物质的量)不相符的是 ( )
A.在AlCl3溶液中滴加氨水至过量 B.向NaOH溶液中滴加AlCl3至过量
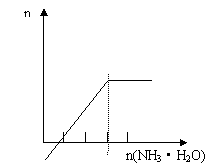

C.向NaAlO2溶液中滴加盐酸至过量 D.向H2SO4溶液中加入NaAlO2溶液至过量


答案:D
7. 由FeO、Fe2O3和Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,,则这种混合物中FeO、Fe2O3和Fe3O4的物质的量之比是 ( )。
A.1:2:1 B. 2:1:1 C. 1:1:1 D. 1:1:3
答案:CD
6. 向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为 ( )
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
答案:B
5. 下列离子方程式中,正确的是 ( )
A.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.氯气与氯化亚铁溶液反应:2FeCl2+Cl2=2FeCl3
C.氯化铁溶液与铁反应:Fe3++Fe=2Fe2+
D.氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓
答案:D
4. 把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,此时若
滴入BaCl2溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( )
A.SO2 B.Fe2+ C.Fe3+ D.NO3-
答案:D
3. 有关铝和它的化合物的说法错误的是 ( )
A.用于熔化烧碱的坩埚,可用Al2O3这种材料制成
B.铝能在空气中稳定存在是因为其表面覆盖着一层氧化铝薄膜
C.氧化铝是一种难熔物质,是一种较好的耐火材料
D. 氢氧化铝能中和胃酸,可用于制胃药
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com