
1.D 2.C 3.C 4.BC 5.D
讲析:1.锌与盐酸是否恰好反应,无法确定。以生成的H2作为计算的依据。2.由消耗的盐酸可知生成CuCl2的量,据铜元素守恒,灼烧28.4g样品可得CuO的质量。4.由Al-1.5H2和Mg(Fe)-H2可知三种金属物质的量的取值范围是0.0833mol-0.125mol。5.由题给信息知:还原性H2SO3 > HBr,有一半Br- 变为Br2,则H2SO3已全部被氧化,由电子守恒可求得。
3.(1)设每天消耗固体硫的质量为x,根据硫元素守恒得 x×95%=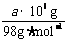 ×32·mol-1×98%
×32·mol-1×98%
x=0.337 a t
(2)每天生产的纯H2SO4的物质的量为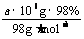 =a×l04mol,因而生产过程中生成的SO2和SO3都是a×l04mol。由于S→SO2,SO2→SO3中所需氧元素均由空气供应,根据氧元素守恒,每天至少消耗空气体积
=a×l04mol,因而生产过程中生成的SO2和SO3都是a×l04mol。由于S→SO2,SO2→SO3中所需氧元素均由空气供应,根据氧元素守恒,每天至少消耗空气体积
V(空气)=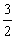 ×a×104mol×22.4L·mol-1×10-3m3·L-1÷21%=1600am3
×a×104mol×22.4L·mol-1×10-3m3·L-1÷21%=1600am3
故理论上至少安装送风机的台数=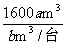 =
=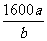 台
台
(3)本小题中“Ψ(O2)的下限”,其含义是指燃烧后剩余的O2在第二步催化氧化时恰好完全反应,即燃烧前空气中的氧恰好满足S+O2=SO2及2SO2+O2 2SO3,两步反应。因上述两步反应的耗O2量之比为2:1,所以燃烧后(第一步反应后)混合气体中O2的体积下限V′=V(空气)x×21%×1/3= V(空气)×7%,由于S+O2=SO2是气体体积不变的反应,故燃烧后混合气体的体积与通人的空气体积y(空气)相等,据此可得:
2SO3,两步反应。因上述两步反应的耗O2量之比为2:1,所以燃烧后(第一步反应后)混合气体中O2的体积下限V′=V(空气)x×21%×1/3= V(空气)×7%,由于S+O2=SO2是气体体积不变的反应,故燃烧后混合气体的体积与通人的空气体积y(空气)相等,据此可得:
Ψ(O2)下限=V(空气)×7%/V(空气)=7%
新活题网站
22.4 a /100(L) <V<22.4 a/84(L)
2.(1)二者以等物质的量混合,可求出二者的质量比。m(NaHCO3)︰m(KHCO3)=84︰100
(2)设盐酸的物质的量浓度为z(mol/L)
NaHCO3+HCl= NaCl+H2O+CO2↑
84 22.4
84a/184 0.1z/2 z=5a/46
如果从KHCO3为基准来计算,可得到同样结果。
(3)盐酸过量时,生成CO2的体积为V:
NaHCO3+HCl= NaCl+H2O+CO2↑
84 22.4
84a/184 V/2
V=22.4a/92(L)或5.6a/23(L)
(4)如果盐酸不足量,则应该用盐酸的量为基准进行计算,这就需要知道盐酸的物质的量浓度。
(5)可以考虑两个极端时的情况,若全部固体为NaHCO3,可放出CO2 22.4 a/84(L),若全部固体为KHCO3,则可放出CO2 22.4 a /100(L),因此体积范围是:
1.NaCl8.700g、KBr0.500g、CaCl20.800g
讲析:正确分析反应前后物质的变化及质量变化对化学计算至关重要,三种盐的混合物通入氯气后溴化钾转变为氯化钾,并造成反应前后固体的质量差(10.000-9.813)g,由差量法可计算出溴化钾的质量;残留物中仅有氯化钙与碳酸钠溶液反应生成碳酸钙沉淀,由碳酸钙的质量计算出氯化钙的质量。
15. 下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期半径最小的金属元素组成的单质,K是一种红棕色气体。
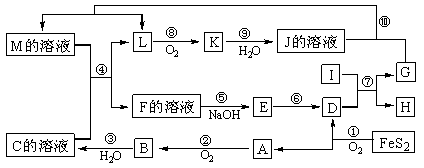
请填写下列空白:
(1)A的化学式为 ,I的原子结构示意图为 。
(2)在周期表中,组成单质G的元素在周期表中的位置是___________________________。
(3)写出反应⑦的化学方程式 。当有0.3 mol电子转移时,生成G的物质的量为 。
(4)在反应②、③、⑥、⑨中,既属于化合反应又能属于非氧化还原反应的是____________(填写序号)。
(5)反应④的离子方程式是:____________________________________________

(6)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:

答案(1)SO2 

(2)第四周期第Ⅷ族
(3)2Al+Fe2O3 Al2O3+2Fe 0.1 mol
Al2O3+2Fe 0.1 mol
(4) ③
(5) 3Fe2++ +4H+ = 3Fe3++NO↑+2H2O
+4H+ = 3Fe3++NO↑+2H2O
(6) Fe2O3+3KNO3+4KOH  2K2FeO4+3KNO2+2H2O
2K2FeO4+3KNO2+2H2O
14. 铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室的Cu2O试样中是否含有Cu进行了认真的探究。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O)。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为a g ,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量。如此反复多次直到质量不变,称得最后质量为c g。分析数据,作出合理判断。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
(2)方案3中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O
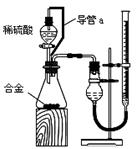
Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示。
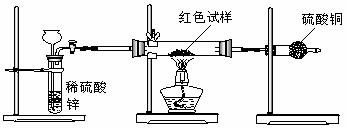
(3)简述新探究方案中,气体发生装置的气密性如何检验(操作、现象、结论):
(4)你认为依据新方案测定上述红色试样成分必须获得下列哪些物理量:(选填序号)
①通入氢气体积;②反应前,红色试样+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管(含药品)的质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管(含药品)的质量
(5)有人提出,在氢气发生器与硬质试管之间应加一个干燥装置,你认为 (选填“需要”或“不需要”),简述理由
答案(1)方案Ⅰ不合理,铜和氧化亚铜都能和硝酸生成Cu2+;方案Ⅱ不合理,Cu+在酸性条件下能发生自身氧化还原反应,也生成了铜单质 
(2)c= (10b-a)
(3)关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置的漏气
(4)②③⑤
(5)需要
反应后,应让铜粉在氢气流中冷却,如没有干燥管,铜粉将吸湿。
13. 利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有
。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂是 ,该还原反应的化学方程式是 。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示) 。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是 。
答案
(1)Fe2O3 + 6H+ = 2Fe3+ + 3H2O,2Fe3+ + Fe = 3Fe2+,Fe + 2H+ = Fe2+ + H2↑
(2)C或CO, 2 CuO+C==2Cu+CO2↑
(3)2Cu+O2+2H2SO4==2CuSO4+2H2O
或2Cu + O2== 2CuO , CuO + H2SO4 == CuSO4 + H2O
(4)生成等量硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2
12. 铜、铁、锌等质量组成的合金W g,加入到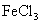 和盐酸的混合液中,充分反应后:
和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有_______ _,还可能有_____ ___.
(2)若剩余固体为W/3 g,则溶液中的阳离子一定有________,可能还有_____ ___.
(3)若剩余固体为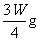 ,则溶液中的阳离子一定有______ __,一定没有_____ ___.
,则溶液中的阳离子一定有______ __,一定没有_____ ___.
解答:
(1)电子氧化性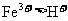 ,而Cu、Fe、Zn全部液解,故一定有
,而Cu、Fe、Zn全部液解,故一定有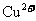 、
、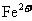 、
、 ,可能还有
,可能还有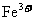 、
、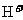
(2)根据氧化还原反应进行的次序规律,因还原性Zn>Fe>Cu,若剩余固体W/3克时,则为Cu,又因为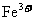 与Cu反应,
与Cu反应,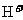 与Cu不反应,故一定有
与Cu不反应,故一定有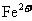 、
、 ,可能还有
,可能还有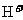 ,一定没有
,一定没有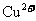 、
、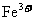
(3)剩余固体为Cu、Fe、Zn,只有部分Zn溶解,加之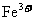 、
、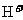 、
、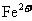 均要与Fe反应,故一定有
均要与Fe反应,故一定有 ,一定没有
,一定没有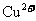 、
、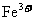 、
、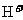 、
、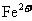
11. (江苏省前黄高级中学09届上学期高三化学第二次周练卷 )铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是 。
[实验步骤]
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01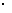 105Pa)的体积
105Pa)的体积
[问题讨论]
(1)同学们拟选用下列实验装置完成实验:
 ①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
 A.待实验装置冷却后再读数
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是 。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为__________mL。
答案.[方案一]2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (1)97mL (2)偏高
[方案二](1)①EDG
②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大 ③ACD
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。 ②V1-V2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com