
10.(10分)化学在环境监测中越来越显示其重要作用,水体受还原性物质(主要是有机物)污染的程度常用化学需氧量(COD)来衡量。COD是指在一定条件下,用强氧化剂处理一定体积水样时所消耗的强氧化剂相当于氧气的质量,单位用mg/L表示。重铬酸钾法是指在强酸性溶液中,用一定量的重铬酸钾氧化(以Ag+作催化剂)水样中的还原性物质,本身被还原为Cr3+,过量的重铬酸钾以试亚铁灵作指示剂,用硫酸亚铁铵溶液回滴,根据相关试剂的用量即可求出水样的化学需氧量(COD)。
(1)当水样中含有浓度较高Cl-时,常需加入HgSO4溶液,HgSO4作用及可能原因是: ▲ 。
(2)滴定时硫酸亚铁铵溶液需盛放在 ▲ (选填:“酸”或“碱”) 式滴定管中。
 (3)国家《生活饮用水标准检验法》(GB5750一85)中酚类的检测下限为0.002mg/L。某水源受化工厂污染,酚含量达0.282mg/L,该污染的水样中酚(以苯酚氧化成CO2计算)引起的化学需氧量(COD)为
▲ mg/L。
(3)国家《生活饮用水标准检验法》(GB5750一85)中酚类的检测下限为0.002mg/L。某水源受化工厂污染,酚含量达0.282mg/L,该污染的水样中酚(以苯酚氧化成CO2计算)引起的化学需氧量(COD)为
▲ mg/L。
(4)某化工园区有两家企业排放出的废水中,某次COD测量值高达2100mg/L,这两家企业最有可能是 ▲ 。
a.制糖厂 b.水泥厂 c.电镀厂 d.造纸厂
(5)现有某废水样品10.00ml,再加10mL蒸馏水,然后加入10.00ml 0.04000mol/L K2Cr2O7溶液,3mL1%硫酸-硫酸银溶液,17mL硫酸汞溶液,加热反应2h。在试亚铁灵指示剂存在下用0.1000mol/L Fe(NH4)2(SO4)2溶液滴定多余的K2Cr2O7,共用去Fe(NH4)2(SO4)2溶液12.00ml。试计算该水样的化学需氧量(COD)。
9.共10分。
(1)导气(1分) a(1分)
(2)吸收溴蒸气(1分)
(3)III中硝酸银溶液内出现淡黄色沉淀(或测反应后III中硝酸银溶液的pH,其pH
变小)(2分)
(4)反应结束后装置II中存在大量的溴化氢,使I的水倒吸入II中可以除去溴化氢气
体,以免逸出污染空气(2分) 关闭K1和分液漏斗活塞,开启K2(1分)
(5)分馏(或蒸馏)(2分)
9. (10分)某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。
(10分)某校学生用如下图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。
请回答下列问题:
(1)冷凝管所起的作用为冷凝回流和 ,冷凝水从 口进入(填“a”或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。III中小试管内苯的作用是 。
(3)能说明苯与液溴发生了取代反应的现象是 。
(4)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中。这样操作的目的是 ,简述这一操作的方法 。
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
① 用蒸馏水洗涤,振荡,分液;② 用5%的NaOH溶液洗涤,振荡,分液;
③ 用蒸馏水洗涤,振荡,分液;④ 加入无水CaCl2粉末干燥;
⑤ (填操作名称)。
8.(16分)
(1) O2、HNO3、NaN3 (6分,每空2分)
|
(3)4HNO3 === 4NO2↑+ O2↑ + 2H2O (2分,条件写成加热也给分)
(4)2NaN3(s) === 2Na(s) + 3N2(g);ΔH = ―10akJ/mol (3分)
 (5)N3― + H2O HN3 + OH― (3分)
(5)N3― + H2O HN3 + OH― (3分)
8.(16分)已知M为两种元素组成的离子化合物,其中金属元素的质量分数为35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。

(1)写出下列物质的化学式:X 、I 、M 。
(2)写出G与H反应的化学方程式 。
(3)实验室中I应保存在棕色试剂瓶中,用化学方程式解释原因 。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式 。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
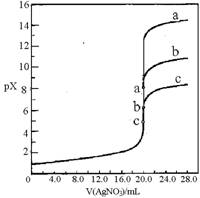
7.用0.1mol·L-1AgNO3溶液分别滴定20.00mL浓度均为 0.1mol·L-1 Cl-、Br-、I-溶液,以滴入的AgNO3溶液体积为横坐标, pX为纵坐标[pX=-lgc(X-),X=Cl-、Br-、I-],可绘得下图滴定曲线。已知25℃时:
|
难溶盐 |
AgCl |
AgBr |
AgI |
Ag2CrO4 |
|
Ksp |
2×0-10 |
5.4´10-13 |
8.3´10-17 |
 2×10-12 2×10-12 |
|
颜色 |
白色 |
淡黄色 |
黄色 |
砖红色 |
有关说法正确的是A
 A.用硝酸银滴定法测定试样中c(Cl-),可滴加0.1mol·L-1
A.用硝酸银滴定法测定试样中c(Cl-),可滴加0.1mol·L-1
 K2CrO4 溶液1-2滴作指示剂
K2CrO4 溶液1-2滴作指示剂
 B.a、b、c依次分别表示Cl-、Br-及I-
B.a、b、c依次分别表示Cl-、Br-及I-
 C.向NaCl和NaBr的混合溶液中滴加硝酸银溶液,
C.向NaCl和NaBr的混合溶液中滴加硝酸银溶液,
 当两种沉淀共存时,c(Br-)/c(Cl-) =2.7×10-4
当两种沉淀共存时,c(Br-)/c(Cl-) =2.7×10-4
 D.若用硝酸银溶液滴定NaI溶液,当pX=13时,
D.若用硝酸银溶液滴定NaI溶液,当pX=13时,
 溶液中c(Ag+)≈0.64´10-17
溶液中c(Ag+)≈0.64´10-17
6.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的C
 A.亚硫酸钠溶液、氯气
A.亚硫酸钠溶液、氯气
B 水、二氧化氮
C.氢氧化钠溶液、一氧化氮
D.氢氧化钠溶液、氨气
5、有一未完成的离子方程式为:□□+XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为( D )
A.+1 B. +4 C.+5 D.+7
4.下列离子方程式的书写正确的是 ( D )
A.铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
 B.碳酸氢钠水解:HCO3-+H2O CO32-+H3O+
B.碳酸氢钠水解:HCO3-+H2O CO32-+H3O+
C.C12通入水中:C12+H2O=2H++Cl-+CIO-
D.氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=3NH4++A1(OH)3↓
3.我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是(设NA代表阿伏加德罗常数)D
A.该氢氧燃料电池是一种具有应用前景的绿色电源
B.该电池工作一段时间后,电解液中KOH的物质的量不变
C.该氢氧燃料电池工作时氢气在负极被氧化
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,理论上有0.1NA电子转移
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com