
1.C 2.C 3 .AC 4.B 5.B 6.B 7.C 8.D
讲析:1.据题意知,金属26g提供电子 ×2=1mol,而四种金属提供1mol电子的质量为12g,9g,28g(Cu不反应),故为Mg与Fe,Al与Fe,Mg与Cu,Al与Cu。 2.依据题给信息,由目标产物减去已知的反应物,再运用原子守恒可求解。 4.观察一系列化合物的结构简式,可知其通式为C2n+2H2n+4O(n≥1),然后求含碳量的极限值。 5.生成2molFeCl2,需FeCl34/3mol,则原FeCl3溶液中溶质质量为
×2=1mol,而四种金属提供1mol电子的质量为12g,9g,28g(Cu不反应),故为Mg与Fe,Al与Fe,Mg与Cu,Al与Cu。 2.依据题给信息,由目标产物减去已知的反应物,再运用原子守恒可求解。 4.观察一系列化合物的结构简式,可知其通式为C2n+2H2n+4O(n≥1),然后求含碳量的极限值。 5.生成2molFeCl2,需FeCl34/3mol,则原FeCl3溶液中溶质质量为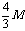 g。假设toC时FeCl3的溶解度为S,则有
g。假设toC时FeCl3的溶解度为S,则有 ,解得S=400M/(3000Vd-4M)g。 6.由生成18g液态水可知H2为1mol,燃烧产生的热量为285.6kJ。由CO燃烧产生的热量为710.0kJ-285.6kJ=424.2kJ,据热化学方程式知需CO1.5mol,占混合气体的50%。 7.该题要求学生熟悉CO2气体与NaOH、Ca(OH)2溶液反应的原理,注意反应的先后顺序。考虑反应物的量,按离子共存规律,其反应先后顺序为
,解得S=400M/(3000Vd-4M)g。 6.由生成18g液态水可知H2为1mol,燃烧产生的热量为285.6kJ。由CO燃烧产生的热量为710.0kJ-285.6kJ=424.2kJ,据热化学方程式知需CO1.5mol,占混合气体的50%。 7.该题要求学生熟悉CO2气体与NaOH、Ca(OH)2溶液反应的原理,注意反应的先后顺序。考虑反应物的量,按离子共存规律,其反应先后顺序为
①Ca(OH)2 +CO2= CaCO3↓+H2O
②2NaOH +CO2= Na2CO3+H2O
③Na2CO3+H2O +CO2=2 NaHCO3
符合反应规律且与离子物质的量相对应的为C。 8.由题设条件可写出总反应式:
aH2S+bO2=( - b) S+(b-
- b) S+(b- )SO2+aH2O,根据总反应式推断A、B、C三选项都对。反应后氧化产物为S、SO2,两者质量和为(16a+32b)g。
)SO2+aH2O,根据总反应式推断A、B、C三选项都对。反应后氧化产物为S、SO2,两者质量和为(16a+32b)g。
2.(1)利用aq中电荷守恒:
n(NO3-)×1=n(Cu2+)×2+n(H+)×1 n(NO3-)=0.2mol
(2)设生成气体中NO2、NO物质的量分别为x、y
由得失电子守恒:x+3y=0.1mol
由“N”元素守恒:x+y=(0.03a-0.2)mol
x=(0.045a-0.35)mol…① y=(0.15-0.015a)mol…②
(3)由题给信息知,要使混合气体完全被NaOH吸收,则V(NO2) ≥V(NO)…③,所以首先要保证产生NO、NO2,列式①②式:x>0,得a>7.8 y>0,得a<10
再由必须完全吸收的条件③式:x≥y得:a≥8.3
则8.3≤a<10
检测提高
1.(1)依题意,5.74g为AgCl,
n(AgCl)=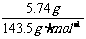 =0.040mol,
=0.040mol,
则:n(BaCl2)=n(AgCl)/2=0.020mol
c(BaCl2)=  =2.00 mol·L-1
=2.00 mol·L-1
(2)由题意知,沉淀质量增加是由BaCO3转化为BaSO4,设BaCO3物质的量为x
BaCO3+ H2SO4= BaSO4+CO2↑+H2O △m
1mol 36g
x 0.18g
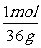 =
=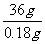 解得:x=0.0050mol n(BaCO3)= n(Na2CO3)=
0.0050mol
解得:x=0.0050mol n(BaCO3)= n(Na2CO3)=
0.0050mol
m(Na2SO4)=1.95g-0.0050mol×106g·mol –1=1.42g
故w(Na2SO4)=  ×100%=72.5%
×100%=72.5%
7.(1)C+CO2= 2CO
(2)Fe、FeO(或名称);CO2
(3)F e、C; CO
(4)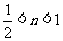 (5)
(5)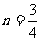
第50课时 (B卷)
纠错训练
6.(1)2CaO2 = 2CaO+O2↑
(2)w(CaO2)=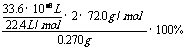 =80%(3)n(CaC2O4)=n(Ca2+)=31.0×10-3L×0.0200mol/L×
=80%(3)n(CaC2O4)=n(Ca2+)=31.0×10-3L×0.0200mol/L×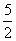
=0.00155mol
 其中CaO2所含的n(Ca2+)=
其中CaO2所含的n(Ca2+)= =0.00133mol
m(CaO)=(0.00155mol-0.00133mol)×56.0g/mol=0.012g
=0.00133mol
m(CaO)=(0.00155mol-0.00133mol)×56.0g/mol=0.012g
 :
: x=
x=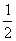
1.A 2.C 3.B 4.B 5.D
讲析:2.将题设情景,用足量的CO还原48.0g氧化物Y的关系式表示如下: Y+CO-CO2-CaCO3
式量 y 28 44 100
实际用量 16.8 26.4 60.0
由关系式中可见足量CO从氧化物样品中夺取了26.4-16.8=9.6g氧,48.0g氧化物中氧占9.6g,金属元素占38.4g,该氧化物中金属元素的质量分数是38.4/48.0=0.80。3.假设等物质的量的硫酸、氢氧化钠溶液与足量的Al完全反应,则产生H2的体积比为2:3 < 5:6,说明乙中铝粉不足,碱过量。4.假设KOH和KHCO3按物质的量之比1:1完全反应, 判断减重情况,与题干比较可得之。
12.45≤W V(CO2)=0
注:30mL HCl(aq)中所含HCl物质的量:
n(HCl)=
CHCl =
和30mL HCL(aq)完全反应的样品的质量:

样品中Na2CO3和盐酸反应完全生成NaHCO3时(没有CO2放出时),样品质量:

新活题网站
4.98≤W≤12.45 V(CO2)=1680-134.9W(mL)
注:V(CO2)=[0.075-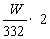 ]×22400(mL)也对
]×22400(mL)也对
2.(1) 504
(2)由题意可知,天然碱含NaHCO3、Na2CO3
n(NaHCO3)=2n(CO2)=2×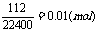
n(Na2CO3)=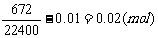
n(H2O)=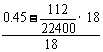 =0.02(mol)
=0.02(mol)
∴天然碱组成:2Na2CO3·NaHCO3·2H2O
(3)2.5
(4)0<W≤4.98 V(CO2)=202.4W(mL)
V(CO2)= 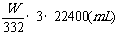 也对
也对
1.(1)
m(CO2+H2O)= 9.3 g m(H2O)=9.3 g-6.6 g =2.7 g
(2)
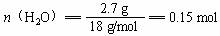
分子中C︰H = 1︰2
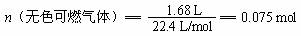

所以该气体的分子式是C2H4
(3)C4H6和H2(或C3H8和CO,C3H6和CH2O等)
讲析:因为单一气体为C2H4,现为等物质的量的两种气体之混合物,所以在2 mol混合气体中,应含有4 mol C原子,8 mol H原子,这两种气体可能是C4H6和H2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com