
10.物质结构与性质(15分)
(1) (2分) (2)三角锥形
(2分)
(2分) (2)三角锥形
(2分)
(3)水分子间除分子间作用力外还形成了氢键,而 分子中只有分子间作用(2分) (4)离子(2分) (5)非极性分子(2分);
3(2分);2(2分);大于(1分)。
分子中只有分子间作用(2分) (4)离子(2分) (5)非极性分子(2分);
3(2分);2(2分);大于(1分)。
10.[物质结构与性质模块]四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质、结构信息 |
同主族气态氢化物最稳定,同周期中基态原子不成对电子数最多的元素;该元素形成的双原子分子一般情况下很稳定。 |
基态原子的M层电子分占两种能级,无空轨道且成对电子与不成对电子所占轨道数相同。 |
短周期中第一电离能最小的元素 |
与A同周期,原子最外电子层上s电子数等于p电子数。单质为空间网状晶体,熔、沸点为同主族单质中最高。 |
(1)写出元素B基态原子的电子排布式___________________________。
(2)元素A形成的气态氢化物的空间构型为______________________。
(3)元素B的氢化物熔点比上一周期同主族元素的氢化物低,原因是_____。
(4)元素B和元素C形成的化合物属于__________(填“离子”、“原子”或“分子”)晶体。
(5)元素D形成的化合物D2H2属于_________(填“极性”或“非极性”)分子。D2H2分子中含________个 键、__________个
键、__________个 键,其中1个
键,其中1个 键的键能___________(填“大于”、“小于”或“等于”)1个
键的键能___________(填“大于”、“小于”或“等于”)1个 键的键能。
键的键能。
9.(14分)(1)过滤(2分),漏斗,玻璃棒(各1分,共2分)
(2)Cu(2分)
(3)因为Hg有挥发性,且有毒。(2分)
(4)Cu+H2O2+H2SO4=CuSO4+2H2O(4分)
(5)冷却结晶(或结晶)(2分)
9. (14分)某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分泥污,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。
(14分)某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分泥污,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。
(1)步骤1的主要操作是 ,需用到的玻璃仪器除烧杯外还有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) 。
(3)步骤2中在分离Hg和固体残渣时,采用在封闭体系中加热、冷凝回收的方法,原因是 。
(4)步骤3之后在B中加入液体混合物X(稀H2SO4和一种绿色氧化剂),仅生成硫酸铜和水,反应化学方程式是 。
(5)步骤4中涉及的操作是:蒸发浓缩、 、过滤、烘干。
8.(12分)
(1) Cl2, SO2, Na2SO3 (各1分)
 (2)①2Cl- + 2H2O
Cl2↑+ H2↑+ 2OH- (2分)
(2)①2Cl- + 2H2O
Cl2↑+ H2↑+ 2OH- (2分)
②BaSO3 +2H+ + SO42- = BaSO4↓+ SO2↑+ H2O (2分)
(3)①变红色(1分); Cl2+SO2+2H2O=H2SO4+2 H Cl (2分)
②先变红后褪色(或褪色)(1分);变红是因为溶液呈酸性,褪色是因为氯气过量生成次氯酸使溶液褪色。 (1分)
8. (12分)A、B均为无色盐溶液,
(12分)A、B均为无色盐溶液,
B的焰色反应呈黄色,一定条件
下A、B可以发生右图所示的物
质之间的一系列变化:
若E为黄绿色气体,F为刺
激性气味的气体,H不溶于稀硝酸。请填写下列空白。
(1)气体E的化学式为_▲_,气体F的化学式为_▲_,B中溶质的化学式为_▲_。
(2)写出下列反应的离子方程式:C→E_▲_;D+G→H_▲_;
(3)试分析E和F按下列两种情况分别通入水中,所得溶液分别滴人几滴石蕊溶液的现象:
①E和F物质的量相等,现象为:_▲_,
原因为(用化学方程式表示)_▲_;
②E和F物质的量不等,且E大于F现象
为:_▲_,原因为(文字说明)_▲_。
7. 下图中,Z为浸透饱和食盐水和酚酞试液的滤纸,水槽中盛有足量CuSO4溶液,X、Y为石墨电极。接通电路后,发现Z上的d点显红色。下列说法正确的是 ( b
)
下图中,Z为浸透饱和食盐水和酚酞试液的滤纸,水槽中盛有足量CuSO4溶液,X、Y为石墨电极。接通电路后,发现Z上的d点显红色。下列说法正确的是 ( b
)
A.接通电路后,水槽中溶液的pH不变
B.b是正极,Y电极上发生氧化反应
C.同温同压F,X、Y两电极上产生气体的体积相等
D.d点显红色是因为接通电路后OH-向d点移动
6.下列文字表述与反应方程式对应且正确的是:D
A.新制的得硫酸亚铁溶液和过氧化氢溶液反应:Fe2++2H++H2O2==Fe3++2H2O
B.硫化钾晶体溶于水:S2-+2H2O 2OH-+H2S
2OH-+H2S
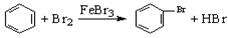 C.亚硫酸氢铵和与足量的氢氧化钠的反应:NH4++OH_= NH3↑+H2O
C.亚硫酸氢铵和与足量的氢氧化钠的反应:NH4++OH_= NH3↑+H2O
 D.实验室用液溴和苯在催化剂作用下制溴苯:
D.实验室用液溴和苯在催化剂作用下制溴苯:
5、工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);△H=+mKJ/mol(m>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上反应(此条件下该反应为可逆反应),下列叙述正确的是 ( D )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为m kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025m kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
4. 为阿佛加德罗常数,下列说法正确的是( A )
为阿佛加德罗常数,下列说法正确的是( A )
A 78克 与过量的
与过量的 充分反应,转移电子数为
充分反应,转移电子数为
B.将 气体溶于水,溶液中
气体溶于水,溶液中 数约为
数约为
C. 克金刚石中含共价键数目为
克金刚石中含共价键数目为
D.
 与
与
 所含电子数均为
所含电子数均为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com