
22、某实验小组同学对电化学原理进行了一系列探究活动。
(1)下图为某实验小组依据氧化还原反应:(用离子方程式表示) 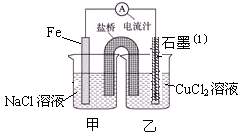 设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过
设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过
mol电子。
(2)其它条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为 ,
这是由于NH4Cl溶液显 性,(填酸性、碱性或中性)用离子方程式表示溶液显此性的原因 ,用吸管吸出铁片附近溶液少许至于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
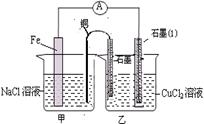 (3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,
一段时间后,在甲装置铜丝附近滴加酚酞试液,现象是 ,电极反应为 ;乙装置中石墨(1)为 极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为 ,产物常用
检验,反应的离子方程式为 。
21、已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,它们之间的相互转化关系如下图所示(部分产物及反应条件没有列出):
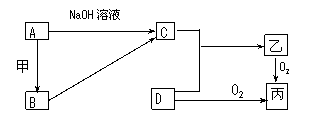
(1)若甲是中学化学中常见的红棕色粉末状固体,则A与甲在一定条件下反应生成B的化学方程式为 ; A与NaOH溶液反应的离子方程式为 。
(2)若通常D为固态,乙气体有臭鸡蛋气味,水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出丙与乙反应的化学方程式 。
(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D为空气中含量最多的单质,写出工业上利用C和D反应制备乙的化学方程式 。
20、由金红石(TiO2)制取单质Ti,涉及到的步骤为:
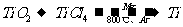
已知:①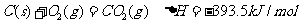
②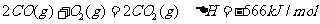
③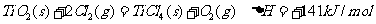
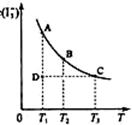
则(1) 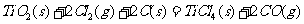 的
的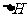 =________________。
=________________。
(2) 碳在氧气中不完全燃烧生成CO的热化学方程式为__________ ____________。
19、(Ⅰ)实验室有贮存以下物质的方法,其中正确的是 (填序号)
①氢氟酸保存在细口玻璃瓶中
②浓硝酸用棕色瓶盛放,贮存在阴凉处
③少量液溴可用水封存,防止溴挥发
④氢氧化钠溶液贮存在带磨口玻璃塞的玻璃试剂瓶中
⑤在实验室少量的金属钠保存在煤油中
(Ⅱ)实验室制取0.5mol/L的NaCl溶液500mL,有以下仪器:
①烧杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有 (填序号),还缺少的仪器是 。
(2)实验两次用到玻璃棒,其作用分别是 、 。
18、观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体 B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
第Ⅱ卷(非选择题,共46分)
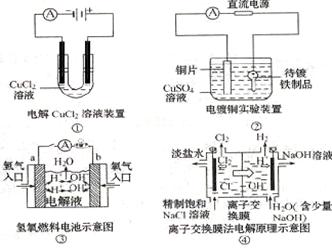
17. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)  I3-(aq) , 某 I2、KI混合溶液中, I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:( )
I3-(aq) , 某 I2、KI混合溶液中, I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:( )
A.反应I2(aq)+I-(aq)  I3-(aq)的△H>0
I3-(aq)的△H>0
B.若反应进行到状态D时,一定有v正>v逆
C.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2
D.状态A与状态B相比,状态A的c(I2)大
16、将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为:CH4 +10OH- -8e- = CO32- + 7H2O ;下列叙述不正确的是 ( )
A. 通入甲烷的一极为负极 B. 通入氧气的一极发生还原反应
C. 该电池总反应为:CH4 + 2O2+ 2OH- = CO32- + 3H2O
D. 该电池在工作时,溶液中的阴离子向正极移动
15、人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO
,37 ℃时,该反应的平衡常数K=220
。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO
,37 ℃时,该反应的平衡常数K=220
。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=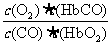
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
14、蓄电池是一种可反复充电、放电的装置。它放电时起原电池的作用,将化学能转变为电能;而充电时电解池的作用,将电能转变为化学能贮存起来。某蓄电池充电和放电时发生的反应为:Fe + NiO2 + 2H2O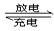 Fe(OH)2 + Ni(OH)2
Fe(OH)2 + Ni(OH)2
关于此蓄电池有下列说法:
①
放电时,NiO 为正极;②充电时,阳极反应式为:Fe(OH)
为正极;②充电时,阳极反应式为:Fe(OH) +2e-→ Fe+2OH
+2e-→ Fe+2OH ;
;
③放电时,电解质溶液中的阳离子向正极方向移动;
④充电时,Ni(OH) 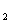 的反应式为:Ni(OH)
的反应式为:Ni(OH) 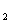 →NiO
→NiO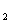 +2H
+2H +2e-;
+2e-;
⑤蓄电池的电极必须浸在碱性电解质溶液中;错误的是
A。 ③ B。② C。①③⑤ D。 ②和④
13、如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuSO4 浓溶液。(该过程中不考虑两球浮力的变化)下列说法正确的是( )
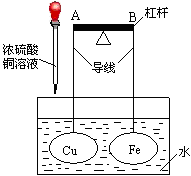 A.若杠杆由绝缘体材料制成,
A.若杠杆由绝缘体材料制成,
一段时间后,杠杆一定B端高A端低
B.若杠杆由导体材料制成,
一段时间后,杠杆一定B端高A端低
C.若杠杆由导体材料制成,
一段时间后,杠杆一定A端高B端低
D.无论杠杆由绝缘体材料还是由导体材料制成,
一段时间后,杠杆一定A端高B端低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com