
3.制备物质
(1)工业冶炼铁,如:Fe3O4+4CO 3Fe+4CO2
3Fe+4CO2
(2)制取氢氧化亚铁
实验原理:
实验现象: 。
要制得白色的Fe(OH)2沉淀,要注意以下几点:
①硫酸亚铁溶液中不能含有Fe3+,因此,硫酸亚铁溶液应是 。
②实验用的氢氧化钠溶液,溶解亚铁盐的蒸馏水应煮沸,以 。
③实验时,用长胶头滴管吸取氢氧化钠溶液后,把滴管插入硫酸亚铁溶液的 ,再轻轻挤胶头滴管的胶头,逐滴加入氢氧化钠溶液,这时就会析出Fe(OH)2白色絮状沉淀。
|
[特别提醒]:Fe(OH)2制备的方法很多,核心问题两点,一是溶液中的溶解氧必须除去,二是反应过程必须与O2隔绝。 |
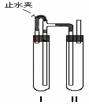 [例1](2008 届金湖中学第二次质量检测)由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法。甲同学:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等制备。
[例1](2008 届金湖中学第二次质量检测)由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法。甲同学:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等制备。

(1)在试管I里加入的试剂是 。
(2)II中的试剂加入前应如何处理: 。
(3)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
乙同学:只是将甲同学所用药品中的铁屑改为FeS固体,其余都与甲相同。
(5)对乙同学的这一改变请你作出评价:__________________________________。
丙同学:认为甲乙两同学所用的装置太复杂,难以组装,该同学应用试管取了一些不含Fe3+的FeSO4溶液,然后向其中加入经煮沸并冷却的NaHCO3溶液,结果也制得了白色沉淀并较长时间保持白色。
(6)请你解释原因并写出相关反应的离子方程式:______________________________。
[解析]用FeSO4溶液与NaOH溶液反应制备Fe(OH)2并观察沉淀的颜色变化是必修Ⅰ重要的演示实验。Fe(OH)2、FeSO4均易被氧化,FeSO4又易水解,应避免生成的Fe(OH)2沉淀接触O2,可得答案。
乙同学将药品中的铁屑改为FeS固体,与稀H2SO4反应生成H2S,H2S有强还原性。
[答案](1)稀H2SO4和铁屑 (2)煮沸 (3)稍等片刻后关闭止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入。
(5)反应中生成的H2S也能防止Fe(OH)2被氧化,白色沉淀能存在较长时间,但易产生空气污染。(6)因双水解反应:Fe2++2HCO3– Fe(OH)2↓+2CO2↑,CO2既能排净试管中的空气,也能防止空气进入试管。
Fe(OH)2↓+2CO2↑,CO2既能排净试管中的空气,也能防止空气进入试管。
[规律总结]制备方法探究
①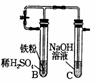 在液面上加隔氧剂:用密度比水小的且不溶于水的有机溶剂,如汽油、苯等物质滴加在反应液面上进行液封,以减少Fe(OH)2与O2接触。(不能用四氯化碳,因为四氯化碳比水密度大,加入它后会处于试管底部,起不到隔离空气的作用。)
在液面上加隔氧剂:用密度比水小的且不溶于水的有机溶剂,如汽油、苯等物质滴加在反应液面上进行液封,以减少Fe(OH)2与O2接触。(不能用四氯化碳,因为四氯化碳比水密度大,加入它后会处于试管底部,起不到隔离空气的作用。)
②用右图装置
向试管中加入煮沸过的稀硫酸,加入稍过量的还原铁粉,充分反应后得到FeSO4溶液,静置。液面上充满氢气。打开止水夹可见白色沉淀。
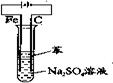 ③用电解实验
③用电解实验
电极材料:石墨碳棒和铁片,(注:铁片表面氧化膜要去掉)将铁片与直流电源的正极连接,石墨棒与直流电源的负极连接。
电解液:可选择Na2SO4溶液或NaOH溶液。 方法:在进行电解前应对电解液进行简单处理:加热一段时间驱赶溶液中氧气,然后再向电解液中加入苯,隔绝空气,防止Fe(OH)2被氧化。
考点2 金、银、铜等金属材料
2.分离与提纯
(1)FeCl2(杂质FeCl3),加入 或 后过滤。
(2)FeCl3(杂质FeCl2),通入 或滴加 或加入“绿色”氧化剂 :
。
1.共存问题
(1)Fe2+在酸性条件下不能与强氧化性离子共存,如: 等。不能与发生复分解和双水解反应的离子共存,如: 等。
(2)Fe3+:不能与还原性离子共存,如: 等。不能与发生复分解和双水解反应的离子共存,如: 等;不能与SCN-共存;不能与苯酚共存。
4. 在经历了一系列苦难之后,这位丹麦王子可以很冷静地处理问题。
After he ______ __________ ___ ___________ _____ difficulties, the Danish Prince could stay _________ and ________ any difficult problems.
3. Joan工作进展顺利。我们都知道,她将会在一部影片中担任一个非常重要的角色。
Joan ____ ___________ ________ _______ ______ her work. As we know, she ______ _______ ____ __________ ________ _____ a film.
2. 信不信由你,使他心烦的是,他到现在还没有爱上一个人。
___________ ____ ___ ___, what upset him most is that he _____ _____ _________ ___ ________ ______ anyone by now.
现在中国比以往任何时候都强大。
_____ __________, China is more powerful ________ _________ _________.
1. 他已经恢复了健康,所以我们本来没必要那么担心的。
He ______ __________ ________ his illness, so we _______ ______ _________ upset ourselves like that.
10. It was no pleasure _______(hide) away for Anne and her family.
9. ______( add) up these numbers and see how much they add up to.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com