
2.考虑水解反应的常见情况
由于水解是微弱的,所以通常情况下不考虑它的影响,但遇到下列情况时必须考虑。
(1)物质的制备有时要考虑盐类水解,如用饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体。
(2)物质鉴别时要考虑盐类水解,如用pH试纸或酚酞溶液鉴别NaCl与NaAC两种水溶液。
(3)配置盐溶液时要考虑盐类水解,如配置Fe2(SO4)3、SnCl2等溶液时要加硫酸和盐酸。
(4)比较盐溶液中离子浓度大小时要考虑盐类水解,如Na2CO3溶液中离子浓度大小排列。
(5)用盐作净水剂,如明矾净水要考虑盐类水解。
(6)化肥合理施用要考虑盐类水解,如草木灰(含K2CO3水解碱性)不要和过磷酸钙(主要含Ca(H2PO4)2酸性)及铵态氮肥(NH4NO3水解酸性)等混合施用。
(7)判断盐溶液的酸碱性时要考虑盐类水解,如Na2CO3溶液水解显碱性,Al2(SO4)3溶液水解显酸性等。
(8)制备某些盐时要考虑盐类水解,如制备Al2S3、无水MgCl2等。
(9)判断酸碱中和滴定终点溶液的酸碱性时要考虑盐类水解。
(10)强酸弱碱盐与强碱弱酸盐溶液混合要考虑盐类水解,如AlCl3与Na2CO3、FeCl3与NaClO两溶液混合发生双水解反应。
1.盐类水解应用十分广泛,它包括:(1)混施化肥;(2)泡沫灭火器;(3)明矾净水;(4)FeCl3溶液止血;(5)判断溶液的酸碱性;(6)比较离子浓度大小;(7)判断离子共存;(8)制备胶体;
(9)盐溶液的配置;(10)物质的制备;(11)试剂的保存;(12)物质的鉴别等。
2.外因:受温度、浓度及外加酸碱的影响。
①温度的影响:盐的水解方向是吸热反应,升高温度可促进水解,水解平衡向右移动,使水解程度增大。
②盐的浓度的影响:将盐溶液加水稀释,水解平衡向右移动,使水解程度(水解度)增大;增大盐的浓度,水解平衡向右移动,但盐的水解程度(水解度)却变小。
③溶液的酸碱度:盐溶液加酸(H+)可抑制阳离子的水解,促进阴离子水解;盐溶液加碱(OH-)可抑制阴离子的水解,促进阳离子水解。
1.内因:盐本身的性质,组成盐的弱酸根对应的酸越弱(或组成盐的阳离子对应的碱越弱),水解程度越大。
3.盐类水解方程式的书写
(1)
盐类水解程度一般微弱,方程式要用可逆号“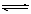 ”表示,产物中的弱电解质不标“¯”或“”,也不写成分解产物的形式。
”表示,产物中的弱电解质不标“¯”或“”,也不写成分解产物的形式。
如:NH4+
+H2O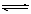 NH3·H2O+ H+ HCO3- + H2O
NH3·H2O+ H+ HCO3- + H2O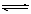 H2CO3 Fe3++3H2O
H2CO3 Fe3++3H2O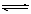 Fe(OH)3+3H+
Fe(OH)3+3H+
(2) 多元弱酸盐的水解方程式要分步写。
如Na2CO3溶液:CO32-+H2O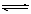 HCO3- HCO3-
+ H2O
HCO3- HCO3-
+ H2O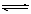 H2CO3
H2CO3
(3) ①双水解反应能进行到底的要用“=”,产物中的沉淀、气体要标“¯”和“”。
如明矾和小苏打两溶液混合: Al3++3HCO3-=Al(OH)3¯+3CO2
如硫化铝在水中的反应:Al2S3+6H2O=2Al(OH)3¯+3H2S
②醋酸铵也能发生双水解反应,但不能进行到底,无气体、沉淀产生,以NH4+、CH3COO-、NH3·H2O、CH3COOH共存,方程式要用可逆号“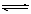 ”表示,产物中的弱电解质不标“¯”或“”。
”表示,产物中的弱电解质不标“¯”或“”。
醋酸铵的水解离子方程式:NH4++CH3COO-+H2O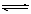 NH3·H2O+CH3COOH
NH3·H2O+CH3COOH
2.盐类水解规律
有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强显谁性,同强显中性。
|
盐的类型 |
实例 |
是否水解 |
离子的水解 |
溶液的pH |
|
强酸强碱盐 |
NaCl、KNO3 BaCl2 |
不水解 |
|
pH=7 |
|
强酸弱碱盐 |
NH4Cl、CuSO4 Fe(NO3)3 |
水解 |
NH4+、Cu2+ Fe3+ |
pH<7 |
|
强碱弱酸盐 |
KClO、Na2S NaHCO3 |
水解 |
ClO-、S2- HCO3- |
pH>7 |
(1)组成盐的弱碱阳离子(M+)能水解显酸性,组成盐的弱酸阴离子(A-)能水解显碱性。
M+ +
H2O 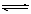 MOH + H+
A- + H2O
MOH + H+
A- + H2O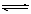 HA + OH-
HA + OH-
(2)盐对应的酸(或碱)越弱,水解程度越大(越弱越水解),溶液碱性(或酸性)越强。
(3)多元弱酸根,正酸根离子比酸式弱酸根离子水解程度大得多,如:CO32-比HCO3-的水解程度大得多,溶液的碱性更强。
(4)弱酸弱碱盐的阴阳离子能双水解,水解程度比单一离子水解程度大,溶液的酸碱性是“谁强显谁性”如:NH4Ac溶液显中性,而(NH4)2S溶液显碱性。
完全双水解的例子:Al3+与CO32-、HCO3-、S2-、HS-、[Al(OH)4]-、ClO-、SiO32-、PO43-、HPO42-等离子发生完全双水解;Fe3+(Fe2+)与CO32-、HCO3-、[Al(OH)4]-、ClO-、SiO32-、PO43-、HPO42-等离子发生完全双水解;NH4+与SiO32-、[Al(OH)4]-等离子发生完全双水解。
1.盐类的水解
(1)水解反应的概念:水溶液中盐的离子与水电离出的H+或OH-结合生成弱电解质的反应。
(2)水解的实质:水解反应破坏了水的电离平衡;促进了水的电离。
(3)水解的条件:①盐必须溶于水中;②盐中必须有弱酸根离子或弱碱阳离子(有弱才水解)。
(4)水解特征:水解属可逆反应,逆反应是中和反应,因此水解方程式要用可逆号“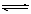 ”。
”。
13.(1)太平洋板块 亚欧地区 美洲板块 非洲板块 印度洋板块 南极洲板块
(2)①太平洋板块与亚欧板块相撞形成的(大洋板块与大陆板块相撞)
②非洲板块与印度洋板块张裂而形成
③亚欧板块与印度洋板块相撞而形成的(或两个大陆板块相撞)
④位于太平洋板块与亚欧板块的交界处,是地壳比较活跃的带
图4表示的是四种地貌景观。读图回答11-12题。

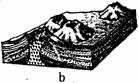
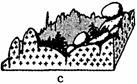

11.表示花岗岩地貌景观的是 ( ) A.a图 B.b图 C.c图 D.d图
12.a图地貌景观形成的主要外力作用是 ( )
A.河流沉积作用 B.湖泊沉积作用
C.冰川侵蚀作用 D.流水溶蚀侵蚀作用
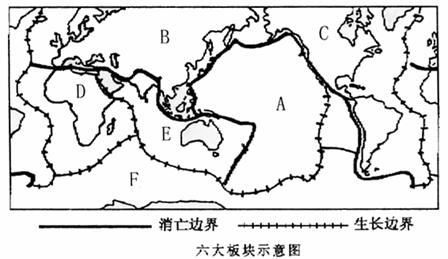 13.读六大板块示意图,完成以下各题:
13.读六大板块示意图,完成以下各题:
(1)写出图中字母代表的板块名称:A B C
D E F 。
(2)用板块构造学说理论解释下列现象的成因:
①太平洋西部的岛弧和海沟的成因是:
。
②红海的面积不断扩大原因是:
。
③喜马拉雅山脉的成因是:
。
④日本多地震的原因是:
[能力训练答案]
1、A 2、D 3.BD 4.AD 5.AD 6.CD 7.BD、8、A 9、C 10、B 11、C
12、D
①黄河
②冲积平原
③侵蚀平原
④喀斯特低山
⑤花岗片麻岩低山
8.这些泉群的主要补给区为
A.③④ B.②③ C.①④ D.①⑤
9.这些泉群的水源主要为
A.土壤水 B.潜水 C.承压水 D.地表径流
10.这次泉水由枯变丰的最主要原因是
A.实施地下水回灌取得成效 B.2003年黄河中下游地区雨量大增
C.退耕还林发挥了良好生态效益 D.南水北调东线将长江的水调入黄河
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com