
2.4.2《求函数零点近似解的一种计算方法--二分法》学案
[学习目标]
①知识目标:掌握二分法求函数零点的一般方法,能借助计算器求函数近似零点。
②能力目标:了解“逼近”这一数学思想,感受体验二分法中的算法思想。
③情感目标:通过合作学习,培养同学们的团结协作的思想品质。
[自主学习]
8.设数列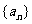 的前n项和为
的前n项和为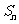 ,且
,且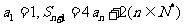 ,
,
(1)设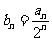 ,求证:数列
,求证:数列 是等差数列;(2)求数列
是等差数列;(2)求数列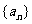 的通项公式及前n项和的公式。
的通项公式及前n项和的公式。
7、已知数列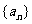 中,
中,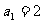 ,且
,且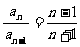 ,则
,则 =________________.
=________________.
6、在数列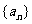 中,
中,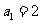 ,
,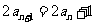 ,则
,则 =_________________.
=_________________.
5、已知数列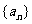 满足
满足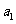 =1,
=1,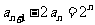 ,则
,则 =_______________.
=_______________.
4、若数列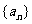 的前n项的和
的前n项的和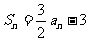 ,那么这个数列的通项公式为
,那么这个数列的通项公式为
A.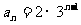 B.
B.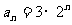 C.
C.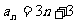 D.
D.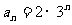
3、 在数列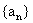 中,
中, 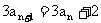
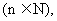 且
且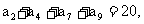 则
则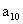 为
为
A. 5 B. 7 C. 8 D. 10
2、已知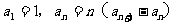 ,则数列
,则数列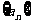 的通项公式
的通项公式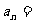
A. 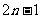 B.
B. 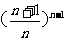 C.
C.
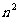 D.
D. 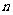
1、已知数列的前n项和为Sn=an-1(a为不为零的实数),则此数列
A、一定是等差数列 B、一定是等比数列
C、或是等差数列或是等比数列 D、既不可能是等差数列,也不可能是等比数列
例1. 常温下,已知0.1mol/L的NaX、NaY、NaZ溶液,其pH值分别为8、9、10,则HX、HY、HZ的酸性强弱排列正确的
A.HX>HY>HZ B.HY>HX>HZ C.HZ>HY>HX D.HZ>HX>HY
解:酸越弱,阴离子的水解程度越大,溶液的pH越大,根据pH的大小可推知Z-水解程度最大,HZ的酸性最弱,而HX的酸性最强,则三种酸的酸性由强到弱的顺序为HX>HY>HZ。 答案为:A
例2.一定温度下,物质的量浓度均为0.1mol/L的下列溶液中①NH4Cl ②NH4HSO4 ③(NH4)2CO3 ④(NH4)2SO4,c(NH4+)由大到小排列___________________________。
解:③、④比较,(NH4)2CO3中的CO32-水解呈碱性,促进了NH4+的水解,故c(NH4+):④>③;
①、②中NH4HSO4电离出来的H+抑制了NH4+的水解,故c(NH4+):①<②。
答案为: ④>③>②>①
例3.将0.1mol/L的AlCl3溶液加热、蒸干、灼烧最后得到的固体是( )
A Al BAl(OH)3 C AlCl3 D Al2O3
解:加热可促进盐的水解,由于HCl挥发,可使水解进行彻底,得到Al(OH)3沉淀,Al(OH)3
灼烧分解,最终产物为Al2O3。
答案为D。
例4.配置BiCl3溶液时有水解产物BiOCl生成而溶液呈浑浊现象。
(1)写出发生该现象的反应的方程式______________________。
(2)医药上常将BiOCl称为次氯酸铋,该名称__________(正确、不正确)。
(3)如何配置BiCl3溶液___________________________________________________。
解:BiCl3溶液中,Bi3+对应的碱Bi(OH)3是弱碱,它水解生成BiOCl,反应的方程式:
BiCl3 + H2O=BiOCl¯+2HCl;在BiOCl中,Cl的化合价为-1价,而次氯酸盐中Cl的化合价应为+1价,故BiOCl不是次氯酸铋;配置BiCl3溶液时由于BiCl3的强烈水解,所以要抑制其水解,具体操作是将适量BiCl3固体溶解在少量浓盐酸中,然后加水稀释。
答案:(1)BiCl3 + H2O=BiOCl¯+2HCl;(2)不正确;(3)BiCl3溶液的配置:将适量BiCl3固体溶解在少量浓盐酸中,然后加水稀释。
例5.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H+
+ OH-,
HB-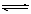 H+ + B2-
H+ + B2-
回答下列问题:
(1)Na2B溶液显____________(填“酸性”,“碱性”,“中性”)。理由是_______________(用离子方程式表示)。
(2)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L a+)+c(OH-)=c(H+)+ c(HB-)
a+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) a+)=2c(B2-)+2 c(HB-)
(3)已知0.1mol/LNaHB溶液的pH=2,则0.1mol/LH2B溶液中c(H+)___________0.11mol/L(填“>”“<”“=”)。HB-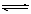 H+ + B2-的电离平衡常数是________________。
H+ + B2-的电离平衡常数是________________。
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
解:(1)H2B=H+
+ OH-(完全电离), HB-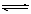 H+ + B2-(部分电离),所以盐中HB-不水解,B2-水解,故Na2B显碱性。离子方程式:B2-+H2O
H+ + B2-(部分电离),所以盐中HB-不水解,B2-水解,故Na2B显碱性。离子方程式:B2-+H2O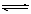 HB-+OH-。
HB-+OH-。
(2)在0.1mol/Na2B溶液中由物料守衡得:c(Na+)=2c(B2-)+2 c(HB-)=0.2mol/L。由电荷守衡得:
c(Na+)+c(H+)=2c(B2-)+ c(OH-)+ c(HB-)。故答案为CD。
(3)已知0.1mol/LNaHB溶液的pH=2,说明c(H+)=0.01mol/L,NaHB电离为主。在H2B溶液中,第一步电离的H+抑制了第二步电离,所以0.1mol/L的H2B溶液中的c(H+)<0.11mol/L。
在0.1mol/LNaHB溶液达到电离平衡时,溶液中的离子平衡浓度:c(H+)= c(B2-)=0.01 mol/L, c(HB-)=0.1mol/L-0.01mol/L=0.09mol/L,根据电离平衡常数的定义知:
Ka=0.012/0.09=1.11×10-3。
(4)在NaHB溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(HB-)>c(H+)>c(B2-)> c(OH-)。
答案:(1)碱性,B2-+H2O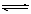 HB-+OH-;(2)CD;(3)<,第一步电离的H+抑制了第二步电离,Ka==1.11×10-3;(4)c(Na+)>c(HB-)>c(H+)>c(B2-)>
c(OH-)。
HB-+OH-;(2)CD;(3)<,第一步电离的H+抑制了第二步电离,Ka==1.11×10-3;(4)c(Na+)>c(HB-)>c(H+)>c(B2-)>
c(OH-)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com