
4、(河南省实验中学2008-2009学年高三第二次月考)数列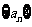 :满足
:满足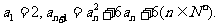
(Ⅰ) 设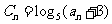 ,求证
,求证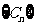 是等比数列;
是等比数列;
(Ⅱ) 求数列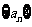 的通项公式;
的通项公式;
(Ⅲ)设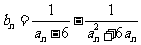 ,数列
,数列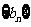 的前
的前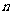 项和为
项和为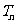 ,求证:
,求证: 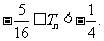
3、已知奇函数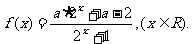
(Ⅰ)试确定实数a的值,并证明f(x)为R上的增函数;
(Ⅱ)记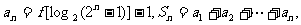 求
求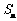 ;
;
(Ⅲ)若方程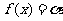 在(-∞,0)上有解,试证
在(-∞,0)上有解,试证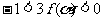
1、(四川省成都市2009届高三入学摸底测试)已知数列的首项为 ,前
,前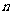 项和为
项和为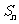 ,且对任意的
,且对任意的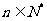 ,当n≥2时,an总是3Sn-4与2-Sn-1的等差中项
,当n≥2时,an总是3Sn-4与2-Sn-1的等差中项
(Ⅰ)求数列{an}的通项公式;
(Ⅱ)设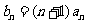 ,
,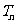 是数列
是数列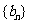 的前项和,
的前项和,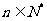 求
求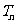 ;
;
(Ⅲ)设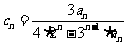 ,
,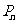 是数列
是数列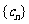 的前项和,,
的前项和,,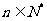 ,试证明:
,试证明: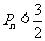
11.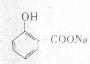 (16分)
(16分)
(1)CH3CH=CH2(2分) (2分)
(2)①②⑤(3分) (3)6(2分)
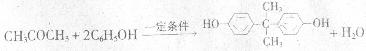 (4)2CH3CH(OH)CH3+O2→2CH3COCH3+2H20(3分)
(4)2CH3CH(OH)CH3+O2→2CH3COCH3+2H20(3分)
(5)12(2分)

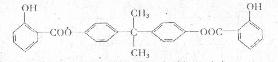
11.(16分)利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,BAD的结构丽式为:
BAD的合成路线如下(已知G不能发生银镜反应):
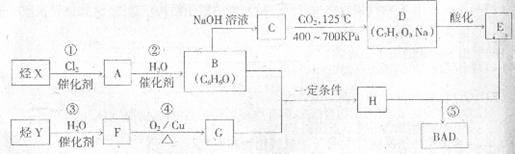
请回答下列问题:
(1)写出结构简式:Y__________________;D____________________________。
(2)反应①-⑤中,属于取代反应的有_____________________________(填数字序号)。
(3)1molBAD最多司与含_______________mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④___________________________________;
B+G→H___________________________________。
(5)遇FeCl3溶液呈紫色的E的同分异构体的数目(含E本身)为___________种。
10.(共17分)
Ⅰ.(7分)
(1)④ 过滤 (1分) 烘干 (1分)
⑤ 取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净 (2分)
(2)① 相同时间内产生气体的体积(或产生相同体积气体所需要的时间) (2分)
② CuO的质量在反应前后是否发生改变(1分)
Ⅱ.(10分)
(3)A(1分) B C(1分)
赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2(或避免Fe2+被氧化)(2分)
(4)① 1 5 8 5 1 4 (2分)
② 酸式 (1分); 当溶液变成紫红色且30s内不褪色 (1分)
③ 80% (2分)
10.(17分)
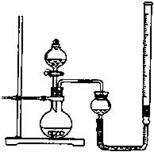
Ⅰ.(7分)某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H2O2的分解反应。
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物_▲_,洗涤,_▲_,然后研细;⑤检查④中洗涤是否完全的操作是_▲_。
(2)用右图所示,按表中设计实验方法,证明CuO能催化
7%H2O2 溶液的分解,并与MnO2的催化效果进行比较。
|
实验序号 |
双氧水体积 |
催化剂 |
待测数据 |
|
a |
15mL |
无 |
|
|
b |
15mL |
0.5g CuO |
|
|
c |
15mL |
0.5g MnO2 |
|
① 从设计原理看,实验中的待测数据是_▲_。
 ② 为探究CuO在实验b中是否起催化作用,除与
② 为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B._▲_。
Ⅱ.(10分)摩尔盐[(NH4)2SO4·FeSO4·6H2O]
在空气中比一般亚铁盐稳定,是化学分
析中常用的还原剂。某研究性学习小组
用右图所示的实验装置来制取摩尔盐,
实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、
铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中。
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞_▲_,打开活塞_▲_(填字母)。向容器①中通人氢气的目的是_▲_。
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部。在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定。若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol·L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL。
①试配平反应的离子方程式:_▲_MnO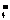 +_▲_Fe2++_▲_H+=_▲_Mn2++_▲_Fe3++
+_▲_Fe2++_▲_H+=_▲_Mn2++_▲_Fe3++
_▲_H2O
②滴定时,将KMnO4溶液装在_▲_(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为_▲_。
③试求产品中摩尔盐的质量分数_▲_。[(NH4)2SO4·FeSO4·6H2O的相对分子质量为392]
9.(每空2分)
(1)> (2)增大 (3)=,a=b+c (4) c
(5)>,由于始终保持较大压强,故反应物的转化率较高,生成的C3比恒容时多,则放出的热量也大。
9.(14分)已知2A2(g)+B2(g)  2C3(g);△H=-a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H=-a kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
(1)比较a____________b(填>、=、<)
(2)若将反应温度升高到700℃,反应达到平衡c(A2)_______(增大、减小或不变)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量ckJ,C3浓度________(填>、=、<)w mol/L,a、b、c之间满足何种关系__________________(用代数式表示)
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出C3气体 ;b、选择高效的催化剂;c、增大B2的浓度
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达平衡后,放出热量dkJ,则d___b(填>、=、<),理由是________________ _。
8.(每空3分)
 ⑴
N2H4(l)+2H2O2(l)==N2(g)+4H2O(g);△H= -817.6KJ/mol
⑴
N2H4(l)+2H2O2(l)==N2(g)+4H2O(g);△H= -817.6KJ/mol
CO2、C2H2、N2O(任写两种)
⑵ NH4+
+ H2O 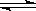 NH3 °H2O + H+
NH3 °H2O + H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com