
1.物理性质:Al(OH)3是几乎不溶于水的 ,具有 性。
0.1mol 0.1mol 0.05mol 0.1mol 0.15mol
若铝箔足量,共生成H2:0.05mol+0.15mol=0.2mol
V(H2)=0.2mol×22.4mol/L=4.48L。
[答案]C
[规律总结]铝和强碱溶液反应,不是铝直接和碱反应,而是铝先和强碱溶液中的水反应生成Al(OH)3,然后Al(OH)3再和强碱反应生成偏铝酸盐。
考点2 氢氧化铝
5.与碱反应
镁不与碱反应,铝与碱液反应: 。
[例1]用铝箔包装0.1mol金属钠,用针扎出一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为(标准状况) ( )
A.O2和H2的混合气体 B.1.12L H2 C.大于1.12LH2 D.小于1.12L H2
[解析]Na与水反应放出H2,并且生成NaOH,铝能与NaOH溶液反应,也生成H2,故最后收集到的气体是这两部分H2总和,显然比Na单独反应产生的H2多。
2Na+2H2O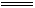 2NaOH
+H2↑
2A1+6H2O
2NaOH
+H2↑
2A1+6H2O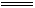 2A1(OH)3+3H2↑
2A1(OH)3+3H2↑
4.与某些氧化物反应
(1)镁与二氧化碳反应:2Mg+CO2
|
[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。 |
(2)铝热反应:2Al+ Fe2O3
铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
|
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3 、FeO、Fe3O4、Cr2O3、V2O5、MnO2等。 ②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。 ③要使用没有氧化的铝粉,氧化铁粉末要烘干。 ④KClO3作为引燃剂,也可以用Na2O2代替。实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。 |
3.与酸反应置换出H2
Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓 H2SO4,冷浓硝酸中发生钝化现象。所以 用铝制容器贮存冷的浓硫酸或浓硝酸。
2.与H2O反应
Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气
Mg+2H2O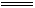 2A1+6H2O
2A1+6H2O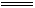
1.与非金属反应
(1)与O2反应。常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。镁、铝都能在空气中燃烧: 。
(2)与卤素单质、硫等反应。Mg+ Cl2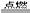 2Al+ 3Cl2
2Al+ 3Cl2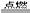
2Al+ 3S (用于工业制备) Mg+ S
(用于工业制备) Mg+ S
|
[特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。镁在空气中燃烧时有三个反应发生: 2Mg+O2  2MgO 3Mg+N2 2MgO 3Mg+N2 Mg3N2 2Mg+CO2 Mg3N2 2Mg+CO2 2MgO+C 2MgO+C②燃烧时都放出大量的热,发出耀眼的白光。利用镁的这种性质来制造照明弹。 ③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。 |
6、信息反馈:
5、延伸作业
用本课学过的说明方法,写一篇小小说明文,向同学们介绍一种自然现象。题目自拟。-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com