
4.2009年5月20日,媒体报道甲型H1N1流感病毒在全世界确诊的感染者突破1万人。此前,国务院总理温家宝5月5日主持召开国务院常务会议,宣布将投入50亿元防控甲型H1N1流感,同时要求地方政府也要进行相应的资金投入。对此,正确的认识是( )
A.防控甲型H1N1流感的资金投入会降低政府的宏观调控能力
B.政府必须量力而行地投入甲型H1N1流感防控资金
C.甲型H1N1流感防控资金投入表明政府必须提供社会公共服务
D.甲型H1N1防控资金是政府提供的经济建设支出
答案:C
3.“通常情况下‘企业管牛,政府管熊’。”也就是说,一般而言,市场环境好的时候,企业自己努力赚钱,市场环境不好时,政府要出手救市。下列属于“政府管熊”的措施有( )
①降低税率 ②降低利息 ③减少国债发行 ④提高贷款利率
A.①③ B.③④
C.①② D.②③
答案:C
2.在现实的社会经济生活中,我们会经常碰到这样的情景:购买商品的时候,当消费者向商家索要发票时,消费者就要多付钱;如果不需要发票,则可以享受到一定的打折优惠。商家的行为是( )
A.是一种偷逃国家税款的行为
B.是一种抗税行为
C.最终有利于消费者
D.是骗税行为,应受到法律制裁
答案:A
1.2009年12月26日8时55分,武广高铁客运新干线首列“和谐号”列车从新落成的武汉火车站启动前往广州,武广高铁通车仪式开始,标志着我国步入高速铁路新时代。武广客运专线投资总额1166亿元。这说明( )
①财政能够集中力量办大事 ②财政能够促进经济社会的发展 ③财政能够促进社会公平 ④财政有助于完善社会保障体系
A.①② B.①②③④
C.①②③ D.①③④
解析:③④材料没有体现。
答案:A
27.(8分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+ 10Al + 18H2O → 3N2↑+ 10Al(OH)3 + 6OH-
(1)现在要除去1m3含氮元素0.3mol的废水中的NO3-(设氮元素都以NO3-的形式存在,下同),则至少需要消耗金属铝__________g。
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
① 写出镁和含氮废水反应的离子方程式:___________________________________
② 已知金属镁是从海水中提取的MgCl2,通过电解制得的。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水_________ kg。
26.(6分)浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24L(标准状况).试计算:
(1)反应后生成硫酸铜的质量.
(2)若将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?
25.(8分)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
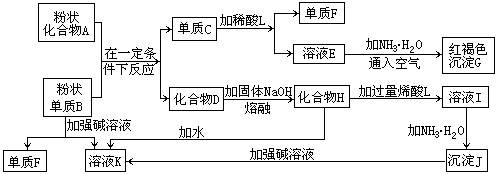 (1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
(1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
24.(10分)(2004年天津高考题)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水
③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
23.(12分)盐酸、硫酸和硝酸是中学阶段所常见的“三大酸”。现请就三大酸与金属铜反应情况,填空回答下列问题:
(1)我们知道,稀盐酸不与Cu反应。在稀盐酸中加入H2O2后,则可使铜顺利溶解。该反应的化学方程式为 。
(2)在一定体积的18mol/L的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积 (填写“大于”、“等于”、或“小于”)lOOmL。
若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗? (填“同意”或“不同意”),原因是 。另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否(简述实验方案和实验现象及由此得出的结论)
。
22. (12分)(1)在硫酸工业生产中,我国采用黄铁矿为原料 生产SO2,反应的化学方程式为:
,该反应在 中进行。
(12分)(1)在硫酸工业生产中,我国采用黄铁矿为原料 生产SO2,反应的化学方程式为:
,该反应在 中进行。
(2)为了有利于SO2的转化为SO3,且能充分利用热能,采 用 了多层催化剂间有热交换器的接触室(见右图)。按此密闭体系中气体的流向,则C处流出的气体为 ,A、B、C三处气体的温度由高到低的顺序为 。
(3)在吸收塔中用 吸收SO3,从吸收塔上部导出的气体再次通入 ,进行第二次氧化,再进行一次吸收后将尾气中很少的SO2净化回收,以防污染大气。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com