
20. 联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)===N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
19. 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
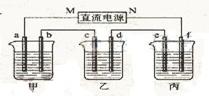
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
 ①电源的N端为______极;
①电源的N端为______极;
②电极b上发生的电极反应为_______________________;
③列式计算电极b上生成的气体在标准状况下的体积:
④电极c的质量变化是_________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液______________________________;
乙溶液______________________________;
丙溶液______________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
____________________________________。
18.
某二元酸(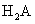 )在水中的电离方程式是:
)在水中的电离方程式是: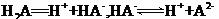 回答下列问题:
回答下列问题:
(1)判断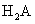 是强电解质还是弱电解质? ,理由是
。
是强电解质还是弱电解质? ,理由是
。
(2)已知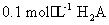 溶液中氢离子的物质的量浓度应
溶液中氢离子的物质的量浓度应
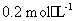 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是
。
(3)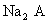 溶液显
(填“酸性”、“中性”或“碱性”)。理由是(用离子方程式表示) 。NaHA液溶中离子浓度的大小顺序是:
。
溶液显
(填“酸性”、“中性”或“碱性”)。理由是(用离子方程式表示) 。NaHA液溶中离子浓度的大小顺序是:
。
(4)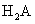 溶液和
溶液和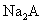 溶液能否发生反应? ,能反应的写出离子方程式
(如不能反应此问不答)
溶液能否发生反应? ,能反应的写出离子方程式
(如不能反应此问不答)
17. (1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
(2)向pH=6的蒸馏水和c(H+)=10-6mol·L-1的稀盐酸中分别投入大小、质量相同的金属钠,反应刚开始时,产生H2的速率前者与后者相比是 (填选项序号)。
A、一样快 B、前者快 C、后者快 D、无法比较
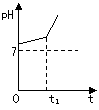 (3)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。
(3)用惰性电极电解NaCl与NaHCO3混合溶液,测得溶液pH变化如下图所示。
① 在0→t时间内,两个电极上的电极反应式为:
阳极 ;阴极 。
②用离子方程式表明0→t时间内,溶液pH升高比较缓慢的原因: 。
16.氮元素可形成卤化物、叠氮化物及络合物等。
(1)NF3构型为三角锥体,沸点-129 ℃;可在铜催化作用下由F2和过量NH3反应得到。
NF3属于 晶体,写出制备 NF3的化学反应方程式: 。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①与N3-互为等电子体的分子、离子有: 、 (各举1例),由此可推知N3-的空间构型是 型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:Co[(N3)(NH3)5]SO4、
(Fe(CN)64-。写出钴原子在基态时的价电子排布式: 。
Co[(N3)(NH3)5]SO4中钴的配位数为 ,CN-中C原子的杂化类型是 。
 (3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体具有水的可溶性,则此种化合物是 (填“极性”、“非极性”)分子。
(3)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体具有水的可溶性,则此种化合物是 (填“极性”、“非极性”)分子。
 (4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是
(选填序号)
(4)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是
(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.第一电离能(I1):N>P>S
C.钠晶胞结构如右图,该晶胞分摊2个钠原子
D.氮气常温下很稳定,是因为氮的电负性小
15.W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶 液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳定性__>__(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
__>__>__>__。
14.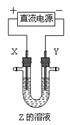 利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
 B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
第Ⅱ卷(共72分)
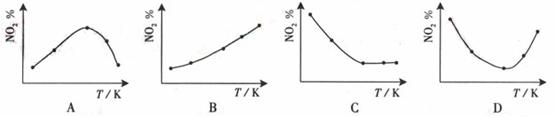
13. 取5等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g),△H<0。反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是BD
N2O4(g),△H<0。反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是BD
12. 下列比较中,正确的是
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF
溶液的 pH 比 NaCN 溶液大
B.0.2 mol·L-1NH4Cl和 0.l mol·L-1 NaOH 溶液等体积混合后:
c(NH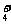 )>c(Cl-)) >c(Na+)>c(OH-)>c(H+)?
)>c(Cl-)) >c(Na+)>c(OH-)>c(H+)?
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH―)
D.同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH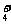 ) 由大到小的顺序是:①>②>③>④
) 由大到小的顺序是:①>②>③>④
11. 对Na、Mg、Al的有关性质的叙述正确的是 ( )
A.碱性:NaOH < Mg(OH)2 <Al(OH)3 B.第一电离能:Na < Mg < Al
C.电负性:Na > Mg > Al D.还原性:Na > Mg > Al
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com