
1. K2Cr2O7 + HCl = KCl + CrCl3 + Cl2 + H2O
⑴ 元素被氧化, 是氧化剂。
⑵ 是氧化产物, 发生氧化反应。
⑶参加反应的盐酸中,起还原剂作用的盐酸与起酸作用的盐酸的质量比为
⑷用短线桥标出电子转移方向和数目
3.

|
|
|
|

氧化剂:得(电子)→降(价降低)→还(还原反应, 被还原)→还(还原产物)
还原剂:失(电子)→升(价 )→氧( , 被 )→氧( )
2.氧化还原反应: 。
⑴氧化剂: 、⑵还原剂 、
⑶被氧化: 、⑷被还原 、
⑸氧化产物: 、⑹还原产物 。
1.化学反应的分类:
。
25.(9分)某厂用石灰石高温煅烧制得生石灰,若每天消耗含杂质5%的石灰石原料300吨。请根据计算回答下列问题:
(1) 理论上每天可生产氧化钙多少吨(假设杂质受热不分解)?
(2) 若每吨石灰石以100元的价格买入,制得的生石灰(含原杂质)以每吨250元卖出,扣除每吨石灰石原料生产的加工费30元,则该厂每天可获利润多少元?
24、(5分)钙是人体必需的元素,它是构成骨胳、牙齿的重要成分,人们可以从牛奶、蔬菜等食物中得到所需的钙元素,如果从食物中摄取的钙元素不足,还可以用含葡萄糖酸钙[化学式为Ca(C6H11O7)2]、碳酸钙等含钙的药物来补充,俗称“补钙”。
(1)葡萄糖酸钙是由 种元素组成的。
(2)葡萄糖酸钙中钙元素的质量分数是 。(精确到0.1﹪)
(3)某人每天需用含1克碳酸钙的药物“补钙”,则他每天补充的钙元素是_______ 克。
23、(8分)用含有二氧化碳和水蒸气杂质的某种还原性气体测定一种铁的氧化物(FexOy)的组成,实验装置如图所示。
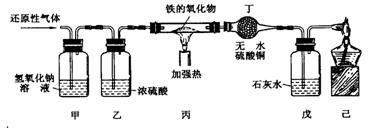
根据上图试回答:
(1)甲装置的作用是 ,反应的化学方程式是 。
(2)实验过程中丁装置没有明显变化,而戊装置中溶液出现了白色沉淀,则该还原性气体是 。
(3)当丙装置中的FexOy,全部被还原后,称量剩余固体的质量为16.8g,同时测得戊装置的质量增加了17.6g。则该铁的氧化物的化学式为 。
(4)上述实验装置中,如果没有甲装置,将使测定结果中铁元素与氧元素的质量的比值 ;(填“偏大”、“偏小”或“无影响”)如果没有最后的己装置,可能产生的后果是 。
22.(12分)实验室中常用高锰酸钾受热分解制取氧气。
(1)写出下图中下列序号的仪器名称:b ;e___________。
(2)为组装此制氧气发生装置,请你从下图中选择所需的仪器(填序号,下同)___________。装药品前应首先进行_______________________。
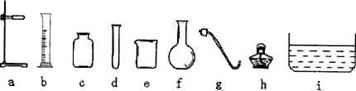
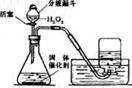 (3)实验室里还可采用右图装置,通过分解过氧化
(3)实验室里还可采用右图装置,通过分解过氧化
氢(H2O2)的方法制取氧气。写出该反应的化学
方程式:______________________________。
此装置中锥形瓶可用上图中的哪些仪器替代________,
收集氧气的方法还可以用________。右图发生装
置还可用于制取的气体有_ 、 。请写出其中一条反应的化学方程式: 。
21、(8分)实验室中现有一种固体混合物,其中可能含有Cu(OH)2、CuO、Cu、NaOH、Na2CO3、CaCl2六种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述。
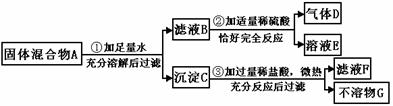
试根据实验过程和发生的现象判断:
(1)产生的气体D是(写化学式,下同) 。
(2)混合物A中,一定存在的物质是 ;一定不存在的物质是 ,原因是 。
(3)滤液F中,一定存在的溶质是 。
(4)写出过程③中可能发生的化学反应中的一个化学方程式:
。
20、(8分)已知在溶液中氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠。现在实验室中有一包白色粉末,可能是碳酸钠,也可能是氧化钙或氢氧化钙。为确定其组成,某同学设计了以下实验方案进行探究,请你按要求帮助完成探究活动。
⑴提出假设:假设①白色粉末是碳酸钠;
假设②白色粉末是氧化钙;
假设③白色粉末是氢氧化钙。
⑵设计实验,通过实验分析进行判断并填空:
|
假设 |
设计的相关实验操作 |
实验中观察到的现象 |
假设是否成立 |
|
① |
取一定量粉末加入稀盐酸 |
没有气体产生 |
|
|
② |
取一定量粉末溶于水 |
溶液浑浊且温度升高 |
|
|
③ |
取一定量粉末溶于水,静置后取上层清液再通入二氧化碳 |
没有沉淀产生 |
|
⑶实验后思考:假定这包白色粉末是混有少量氧化钙的碳酸钠粉末,将混合物溶于水中可观察到的现象是 ;若将反应后的混合物进行固液分离,分离的方法是 ;再将分离后的溶液蒸干,得到的固体物质是 、 (填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com