
17、①M(OH)2+2NaHCO3=MCO3↓+Na2CO3+2H2O ②B ③137,58.8克
8.D 9.D 10A
11D 12A 13BD 14B 15C
16①a=b ②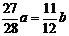 ③
③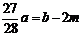
7.⑴2:3 ⑵24 27
6.1800.9
1.C 2.B 3.D 4.D 5.B
2.⑴NH4+、Fe2+,SO42-)
⑵据题意:n(SO42-)=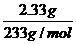 =0.01mol
=0.01mol
5Fe2+ + Mn04-+ 8H+ = 5Fe3+ + Mn2+ + 4H2O
5 1
n(Fe2+) O.001 mo1
n(Fe2+)=O.001 mol×5=0.005mol
根据离子化合物中阴、阳离子电荷平衡的原理,n(NH4+)+2n(Fe2+)=2n(SO42-)
n(NH4+)=O.01 mol
n(H2O)=
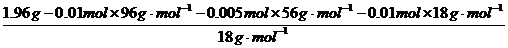 .
.
=O.03 mol
[针对训练]
1. AD
2.[解析]由题设条件,可看作气体A的式量为m,气体B的式量为n(这是至为关键的)本题即为阿佛加德罗定律及引伸的运用,显然在运用时注意前提条件A中缺少同温同压条件,只有同温同压下,体积相同,则A、B物质的量相同。质量比才为m:n,而B中与温度压强没有关系,但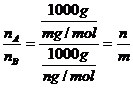 ,C中同温同压密度比等于其式量比,应为m:n,因此正确答案为A、B、C。
,C中同温同压密度比等于其式量比,应为m:n,因此正确答案为A、B、C。
[答案]D
[考题再现]
1.[解析]由于含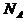 个微粒为1mol ,所以含
个微粒为1mol ,所以含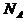 个H原子的
个H原子的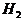 中含氢原子为1mol,而1个氢分子中含有2个氢原子,则含
中含氢原子为1mol,而1个氢分子中含有2个氢原子,则含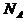 个H原子的
个H原子的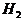 的物质的量为0.5mol。选项A错。由于CO和
的物质的量为0.5mol。选项A错。由于CO和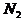 的摩尔质量相同,故
的摩尔质量相同,故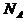 个分子的质量也相同,且为了加28g,故选项B正确。1mol
个分子的质量也相同,且为了加28g,故选项B正确。1mol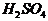 和
和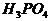 分别含有2mol H和3mol H,故选项C错。5.6g铁离子为0.1mol ,得到0.2mol 电子后,刚好全部形成原子。故选项D正确。
分别含有2mol H和3mol H,故选项C错。5.6g铁离子为0.1mol ,得到0.2mol 电子后,刚好全部形成原子。故选项D正确。
[答案]B、D
17.向某二价金属M的氢氧化物澄清溶液100毫升中加入过量的NaHCO3溶液生成MCO3沉淀,过滤,将沉淀置于足量盐酸中放出标准状态下的气体4.48升。将滤液加水稀释到250毫升,取出25毫升恰好与20毫升盐酸完全反应,并在标准状态下收集到1.12升气体。
⑴写出M的氢氧化物澄清溶液与NaHCO3溶液反应的化学方程式
⑵要计算金属M的相对原子质量,你认为还必须提供下列哪项数据?(填标号)
A.M的氢氧化物的物质的量的浓度(设为2mol/L)
B.M的碳酸盐的质量(设为39.4克)
C.与M的碳酸盐反应的盐酸的物质的量浓度
D.题给条件充足,不需要补充数据
⑶根据你的选择计算金属M的相对原子质量和加入NaHCO3溶液中NaHCO3的质量
第 三章 物质的量第一课时 物质的量和气体摩尔体积
[例题解析]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com