
23、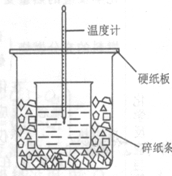 (8分)50ml0.50mol/L盐酸与50ml0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。
(8分)50ml0.50mol/L盐酸与50ml0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
⑴从实验装置上看,图中尚缺少的一种玻璃用品是: ;
⑵烧杯间填满碎纸条的作用是: ;
⑶大烧杯上不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”、“无影响”)
⑷实验中改用60ml0.50mol/L盐酸与50ml0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 (填“相等”、“不相等”),简诉理由: ;
⑸用相同浓度和体积的氨水代替氢氧化钠进行上述实验,
测得中和热的数值 ,用50ml0.50mol/LNaOH溶液进行实验,测得的中和热的数会(填“偏大”、“偏小”、“无影响”)。
22、(10分)有人设计了如图所示的一个电解氯化钠溶液的装置,a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时向两边各滴入几滴酚酞试液,则:
① 电解池中X极上的电极反应式为 ,在X极附近观察到的现象是__________。
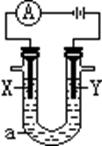 ② Y电极上的电极反应式为
,检验Y电极反应产物的方法是__________。
② Y电极上的电极反应式为
,检验Y电极反应产物的方法是__________。
③写出电解过程中的总化学方程式 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
③写出电解过程中的总化学方程式 。
21、(8分)工业制硫酸分三个阶段,按要求填空:
(1)写出燃烧硫铁矿的化学方程式: ,此反应在 中进行(填设备名称)
(2)第二阶段的反应方程式为 ,设备名称 ,
(3)若160gSO3气体与H2O化合放出260.6KJ热量,则该反应的热化学方程式为 。
20、在25℃时,用铂电极电解一定量的Na2SO4 饱和溶液,一段时间后,阳极析出amol气体,同时溶液中析出bg Na2SO4·10H2O,如果在这一过程中温度不变,则此时Na2SO4溶液中溶质的质量分数为( )
A、(71/161)×100℅ B、(71b/161(18a+b))×100℅
C、(b/(18a+b))×100℅ D、(71b/161(36a+b))×100℅
19、下列各项中顺序排列错误的是( )
A、热稳定性:PH3>H2S>HCl>NH3
B、熔点:石英>食盐>白磷>冰
C、作用力大小:共价键>氢键>范德华力
D、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
18、 已知:2H2(g)+ O2(g)=2H2O(l) ;ΔH= -571.6KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ;ΔH= -890KJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1∶1 B.1∶3 C.1∶4 D.2∶3
17、以惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.0100 mol,则阴极上析出Cu的质量为 ( )
A.1.28 g B.0.64 g C.2.56 g D.5.12 g
16、下列各离子可以大量共存、加入括号中的试剂,可以形成无色澄清溶液的是( )
A、Mg2+、Cu2+、NO3-(稀盐酸) B、Ag+、Al3+、NO3-(氨水)
C、Al3+、K+、SO42-(NaOH溶液) D、Ba2+、Na+、SO32+(稀HNO3)
15、在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A、黄铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中燃烧
B、从沸腾炉出来的炉气需要净化,因为炉气中SO2会与杂质反应
C、SO2氧化SO3时需要使用催化剂,这样可以提高SO2的转化率
D、SO3用98.3℅的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全
14、下列物质的熔点由高到低的排列正确的是( )
A、Cs>K>Na>Li B、F2>Cl2>Br2>I2
C、金刚石>硅>碳化硅 D、NaCl>KCl>RbCl>CsCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com