
10.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原,现用15.00mL 0.049 mol/L羟胺的酸性溶液与足量硫酸铁溶液反应(Fe3+转变为Fe2+)。生成的Fe2+ 恰好与24.50mL 0.020 mol/L KMnO4酸性溶液完全作用:
2KMnO4 + 6FeSO4 + 4H2SO4 = 3Fe2(SO4)3 + K2SO4 + 4H2O + 2MnO2,则上述反应中羟胺的氧化产物为( )
A.N2 B.N2O C.NO D.NO2
9.被称为万能还原剂的NaBH4(H元素为-1价)溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是 ( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是还原剂,H2O是氧化剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素的物质的量为1︰2
8、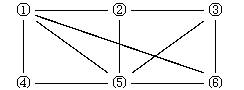 如右图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能
如右图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2。凡是直线相连的两种物质均能
发生化学反应(已知高温时氨气能还原
Fe2O3。)图中①表示的物质是( )
A.Al B.NaOH溶液
C.氢碘酸 D.O2或Fe2O3
7.已知SO32-+I2+H2O=SO42-+2I-+2H+。某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色。则下列关于该溶液组成的判断正确的是( )
A.肯定不含I- B.肯定不含Cu2+C.可能含有SO32- D.肯定不含有NH4+
6、现有CuO和Fe2O3组成的混合物a g,向其中加入4.0 mol•L–1硫酸溶液25 mL时恰好完全反应。若将a g原混合物在足量CO中加热,使其充分反应,冷却后剩余固体质量为( )
A.1.6 g B.1.6a g C.(a-0.8) g D.(a-1.6) g
5、常温下,下列溶液可能大量共存的离子组是( )
A.含有大量S2-的溶液:Na+、C1O-、C1-、CO32-
B.含有大量Fe3+的溶液:K+、Na+、A1O2-、SO42-
C.能使pH试纸变红的溶液:NH4+、Na+、NO3-、HCO3-
D.水电离产生的c(H+)=1×10-12mol·L-1的溶液:Mg2+、SO42-、NO3-、C1-
4、参照反应Br+H2
 HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
A. 该反应的△H=+(E1-E2)kJ/mol
B. 加入催化剂,该化学反应的反应热变大
C. 反应物总能量高于生成物总能量
D. 升高温度可增大正反应速率,降低逆反应速率
3、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。
湿法制备的主要反应方程为:2Fe(OH)3+3ClO―+4OH―=2FeO42-+3Cl―+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2=2Na2FeO4 +2Na2SO4
下列有关说法不正确的是( )
A.高铁酸钾中铁显+7价
B.湿法中每生成1mol Na2FeO4转移3 mol电子
C.干法中每生成1mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质
2、某溶液中存在XO3―,且X为短周期元素,则一定能在该溶液中大量共存的离子组是( )
A.Na+.H+.SO42―.I― B.Na+.Ca2+.CO32―.Al3+
C.Na+.K+.Fe2+.H+ D.K+.SO42―.Cl―.CO32―
1、能正确表示下列反应的离子方程式是( )
A.氨水中通入过量CO2:2NH3·H2O + CO2 = 2NH4+ + CO32- + H2O
B.氯化亚铁溶液中加入硝酸:Fe2+ + 4H+ + NO3- = Fe3+ + 2H2O + NO↑
C.将标准状况下112 mL氯气通入10 mL 1 mol·L-1的溴化亚铁溶液中:
2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 6Cl- + 2Br2
D.用小苏打治疗胃酸过多:HCO-3+H+ = CO2↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com