
4. 家用电能表是用来测量___ __的仪表。如图是小红同学家8月30日和9月30日显示的数字。小红家9月份消耗了_ __KW·h的电能。如果每1KW·h的电能价格是0.45元,小红家这个月的电费是__ __元。
家用电能表是用来测量___ __的仪表。如图是小红同学家8月30日和9月30日显示的数字。小红家9月份消耗了_ __KW·h的电能。如果每1KW·h的电能价格是0.45元,小红家这个月的电费是__ __元。
3.电炉丝和铜导线串联接在电路中,通电后电炉丝热的发红而铜导线却不怎么热,这是因为电炉丝和铜导线中的_____相等,但电炉丝比铜导线的_____大,消耗的电功率多的缘故。
2.家庭电路中,照明灯泡与控制它的开关之间的连接方式是_____. 一只标有“PZ220一100”字样的白炽灯泡,其额定电压是______V,额定功率是______W,若灯泡两端电压减小,灯泡的亮度将______.
1.从功能关系看,电流做功的过程,实质是______能转化为______能的过程。电流通过“电动机”时,电能主要转化为_______能;电流通过正在充电的铅蓄电池时,电能主要转化为________能.
20.0 g×14%+30.0 g×24%=10.0 g
混合溶液中溶质的质量分数为:×100%=20%
(2)n(NaCl)=,
V(溶液)=
c(NaCl)=
=×
=4.0 mol·L-1
(3)×100%=20%
n(NaCl)=4.3 mol
答案:(1)20% (2)4.0 mol·L-1 (3)4.3
23.(6分)(2009·广东省高三第一学期期末调研)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液。计算:
14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液。计算:
(1)该混合溶液中NaCl的质量分数。
(2)该混合溶液中NaCl的物质的量浓度。
(3)在1000 g水中需加入________摩尔氯化钠,才能使其浓度恰好与上述混合溶液浓度相等。(保留1位小数)
解析:(1)混合溶液的质量为:20.0 g+30.0 g=50.0 g混合溶液中溶质的质量为:
22.(6分)(2009·山东淄博4月)实验室需要配制0.5 mol·L-1的烧碱溶液500 mL,根据溶液配制的过程,回答下列问题:
(1)实验中除了托盘天平(带砝码)、药匙、量筒和玻璃棒外,还需要的其他玻璃仪器有:________________________________________;
(2)根据计算得知,所需NaOH固体的质量为________g;
(3)配制溶液的过程中,有以下操作。其中正确的是________(填代号)。
A.将氢氧化钠固体放在纸片上称量
B.在烧杯中溶解氢氧化钠固体后,立即将溶液倒入容量瓶中
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2-3次,并将洗涤液转移到容量瓶中
解析:(2)m=0.5 mol·L-1×0.5 L×40 g·mol-1=10.0 g
(3)A中氢氧化钠固体应用烧杯称量;B中要等溶液冷却到室温后再转移到容量瓶中。
答案:(1)500 mL的容量瓶、烧杯、胶头滴管 (2)10.0 (3)C
21.(14分)(2009·山东省烟台市高三模块检测)某学习小组在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,以及稀硫酸和宽度、厚度均匀的纯镁带测定气体摩尔体积,假如实验是在标准条件下进行,试回答下列问题:
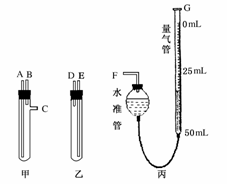
(1)甲乙两试管各有两根导管,用橡胶管连接对应接口后,若倒置盛稀硫酸的试管,可发生反应放出气体。镁带和稀硫酸应分别置于________、________仪器 中(填仪器编号);接口的连接方式是:A接________,B接________,C接________(填写各接口的编号)
中(填仪器编号);接口的连接方式是:A接________,B接________,C接________(填写各接口的编号)
(2)仪器丙由左右两部分组成,它们用橡胶管连通,并装入适量水(含少量食盐)。G管可以用化学实验室中的一种常用仪器改装,该仪器的名称是________。反应结束后读数时,除应将温度恢复至0℃,还应采取的措施是________。
(3)实验中需取用一定质量的镁带放入试管中,取用的质量应小于________g;取用实验需要的镁带,能否用化学实验室常用的托盘天平________,理由是________;正确取用镁带的方法是__________________________________。
(4)如果镁带长Lm,质量为mg。实验中截面镁带长x cm,产生气体的体积为V mL,则测得标况下气体摩尔体积应表示为V (m)=________.
(5)实验中若取用的镁带表面部分被氧化,则导致测定结果________;若稀 硫酸取用不足量,则导致测定结果________;若读数时量气管内液面高于水准管内液面,则导致测定结果________(填偏高、偏低或无影响)。
硫酸取用不足量,则导致测定结果________;若读数时量气管内液面高于水准管内液面,则导致测定结果________(填偏高、偏低或无影响)。
答案:(1)甲、乙(1分);D,E, F(2分)
F(2分)
(2)50 mL碱式滴定管(1分);上下移动量气管使量气管液面与水准管液面相平(1分)。
(3)0.05(1分);不能(1分);托盘天平的感量为0.1 g(1分);用标准卷尺量取(1分)
(4)12VL/5mx L·mol-1(2分)
(5)偏低(1分);偏低(1分);偏低(1分)
20.(8分)(2008·四川高考调研)某无色透明溶液可能含有下列离子K+、Al3+、Fe3+、Ba2+、NO、SO、HCO、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
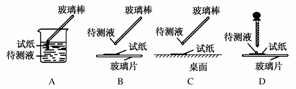
(1)在实验①中,下图所示的操作中正确的是________(填代号)。
(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子是________。
(3)写出与②和③两个实验有关的离子方程式:
②_____________________________________ _________________
_________________ __________________。
__________________。
③________________________________________________________________________。
解析:在判断离子共存时,注意题干中的隐含条件。由于溶液为无色透明的,排除了Fe3+的存在;由①可知溶液显酸性,排除了HCO的存在;由②可知 溶液中有NO存在;由③可知有Al3+存在;由④可知有SO存在,排除了Ba2+的存在;由于④引入了Cl-,所以无法判断原溶液是否含有Cl-。综上所述一定有NO、Al3+、SO;一定无Fe3+、Ba2+、HCO。
溶液中有NO存在;由③可知有Al3+存在;由④可知有SO存在,排除了Ba2+的存在;由于④引入了Cl-,所以无法判断原溶液是否含有Cl-。综上所述一定有NO、Al3+、SO;一定无Fe3+、Ba2+、HCO。
答案:(1)BD
(2)NO、Al3+、SO Fe3+、Ba2+、HCO
(3)②Cu+8H++2NO===3Cu2++2NO↑+4H2O
③Al3++3NH3·H2O===Al(OH)3↓+3NH
95.(3)偏高
(4)4%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com