
13.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2;NaCN+HF===HCN+NaF;NaNO2+HF===HNO2+NaF。
由此可判断下列叙述不正确的是 ( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得到一元弱酸的强弱顺序为:HF>HNO2>HCN
D.K(HCN)< K(HNO2)<K(HF)
K(HNO2)<K(HF)
答案:B
12.(20 09·辽宁)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是 ( )
09·辽宁)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是 ( )
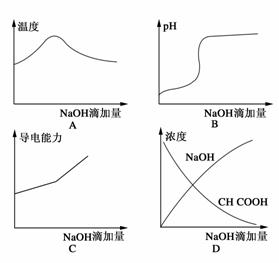
解析:在CH3COOH未完全中和完以前,c(NaOH)趋于0。
答案:D
11.(2009·广东)下列说法正确的是 ( )
A.向0.1 mol·L-1Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO、Cl-、CO、Na+可大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
解析:B中Al3+与CO、CO与H+不能大量共存;C中乙醇属于非电解质,D中H2SO4消耗的NaOH多。
答案:A
10.(2009·重庆)各可逆反应达到平衡后,改变反应条件,其变化趋势正确的是 ( )
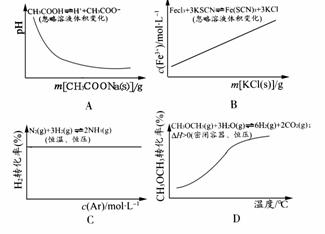
解析:A项:加入CH3COONa(s)使溶液中c(CH3COO-)增大,抑制电离,pH增大;B项:原平衡实质为Fe3++3SCN-Fe(SCN)3加入KCl(s)无影响;C项:恒压充入Ar会使容器体积增大(相当于减压);D项:升高温度,平衡正向移动。
答案:D
9.化合物HIn在水溶液中存在以下电离平衡,可用作酸碱指示剂:HIn(aq)(红色)H+(aq)+In-(aq)(黄色),浓度为0.02 mol·L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水。其中能使指示剂显红色的是 ( )
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
答案:C
8.将pH相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断,其中正确的是( )
(1)所需时间:乙<甲 (2)开始时反应速率:甲>乙 (3)参加反应的锌的质量:甲=乙 (4)整个反应阶段的平均速率:乙>甲 (5)盛盐酸的容器中有锌剩余 (6)盛醋酸的容器中有锌剩余
A.(1)(2)(3)(5) B.(1)(3)(5)
C.(2)(3)(6) D.(1)(3)(4)(5)
解析:由于甲为盐酸,乙为醋酸,因此两溶液H+物质的量浓度相同时,醋酸的物质的量浓度比盐酸大得多。又因两份溶液等体积,所以醋酸的物质的量比盐酸大得多。由于开始反应时的H+物质的量浓度相同,因此开始反应的速率相同。
答案:D
7.(2009·山东省淄博市模拟)分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是 ( )
①两溶液的体积相同,酸是多元强酸 ②两溶液的体积相同,酸是一元弱酸 ③酸溶液的体积大于NaOH溶液的体积 ④酸是强酸,浓度比NaOH溶液的大
A.①② B.② C.②③ D.④
解析:产生H2的量相等时,n(H+)=n(OH-),产生H2多,则一定是n(H+)>n(OH-),而pH=1的酸中c(H+)与pH=14的NaOH溶液中c(OH-)相比前者小, 所以有两种情况可产生题设结果:一是等体积时,酸是一元弱酸,二是酸的体积大。答案为C项。
所以有两种情况可产生题设结果:一是等体积时,酸是一元弱酸,二是酸的体积大。答案为C项。
答案:C
6.在25℃时,0.1 mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,它们的电离平衡常数分别为4.6×10-4mol2·L-2、1.8×10-4mol2·L-2、4.9×10-10mol2·L-2、K1=4.3×10-7mol2·L-2和K2=5.6×10-11mol2·L-2,其中氢离子浓度最小的是 ( )
A.HNO2 B.HCOOH C.HCN D.H2CO3
解析:弱酸的浓度相同时,K值越小(多元弱酸看K1),酸性越弱,氢离子浓度越小。
答案:C
5.氢氟酸是弱酸,电离方程式为HF H++F-,达到电离平衡的标志是 ( )
H++F-,达到电离平衡的标志是 ( )
A.c(H+)=c(F-)
B.v(电离)=v(结合成分子)
C.溶液显酸性
D.单位时间内,电离的HF分子数与生成的F-数相等
答案:B
4.下列叙述中,能证明某物质是弱电解质的是 ( )
A.熔化时不能导电
B.不是离子化合物是共价化合物
C.水溶液的导电能力很差
D.溶液中存在电离平衡,电离出的离子和未电离的分子共存
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com