
12.(15分)NaHSO4是一种酸式盐:
(1)NaHSO4晶体熔化时的电离方程式为
(2)NaHSO4溶于水配成稀溶液时,电离方程式为
(3)NaHSO4溶液与NaHCO3溶液反应的离子方程式为
(4)2 mol/LNaHSO4与1 mol/L的Ba(OH)2溶液等体积混合,反应的离子方程式为
若在反应的溶液中再继续滴加Ba(OH)2溶液,反应的离子方程式为
11.(6分)下列物质中,属于强电解质的是 ;属于弱电解质的是 ;属于非电解质的是 。(填序号) ①氨气 ②氯水 ③硫酸钡 ④氯气 ⑤醋酸铵 ⑥铜 ⑦酒精 ⑧甲酸
10.在含有酚酞的0.1mol/L的氨水溶液中加入少量的NH4Cl固体,则溶液颜色
A.变蓝色 B.变深 C.变浅 D.不变
9.某浓度的氨水中存在下列平衡:NH3·H2O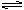 NH4+ + OH-;,如想要增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是
NH4+ + OH-;,如想要增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是
A.适当升高温度 B.加入NH4Cl固体 C.通入NH3 D.加水稀释
8.下列各组物质中,溶液的导电性比反应前明显增强的是
A.向亚硫酸钠溶液中加入少量液态溴
B.向硝酸银溶液中加入少量盐酸
C.向氢氧化钠溶液中通入少量氯气
D.向溴化氢饱和溶液中通入适量氯气
7.下列电离方程式正确的是
A.NaHCO3溶于水:NaHCO3 = Na+ + H+ + CO32-
B.NaHSO4熔化:NaHSO4 = Na+ + HSO4
-C.(NH4)2SO4
溶于水:(NH4)2SO4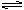 2NH4+
+ SO42-
2NH4+
+ SO42-
D.水溶液中:2H2O = H3O+ + OH-
6.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电能力变化最小的是
A.自来水 B.0.5mol/L盐酸 C.0.5mol/L醋酸 D.0.5mol/L氯化钾
5.将一定体积的0.1mol/L醋酸溶液蒸发掉二分之一体积的水(设醋酸不挥发),下列叙述正确的是
A.溶液中c(H+) 减小 B.电离度减小
C.溶液导电能力不变 D.中和此溶液所需0.1mol/lNaOH溶液的体积减小
4.用足量Na2CO3与一定量的稀硫酸反应制取CO2时,若要减慢反应速度,又不减少生成CO2的体积(相同状况),可加入的物质是
A.Na2SiO3固体 B.BaCl2固体 C.KOH固体 D.无水CH3COONa
3.能判断某酸是弱电解质的是
A.该酸受热能分解 B.该酸能与氨水发生中和反应
C.能用强酸和盐反应制该酸 D.0.01mol/L的该酸c(H+)=1×10-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com