
11. ⑴A:HOCH2CHO ;B:CH3CH2CHO ;C:CH2=CH-CHO。⑵CH3CH2CH2OH ;CH3CHOHCH3 。⑶HCOOCH3 ;CH3COOH
1. A; 2.B; 3. B ; 4. C; 5.A; 6 C ; 7. C ; 8. B ; 9.BC; 10. C;
5. C解析:
 A项,根据键线式,由碳四价补全H原子数,即可写出化学式,正确;B项,由于分子可存在碳碳双键,故可以发生加聚反应,正确;C项,13个碳应消耗13个O2,20个H消耗5个O2,共为13+5-0.5=17.5,故错;D项,碳碳双键可以与Br2发生加成发生,然后水解酸化,即可得Br-,再用AgNO3可以检验,正确
A项,根据键线式,由碳四价补全H原子数,即可写出化学式,正确;B项,由于分子可存在碳碳双键,故可以发生加聚反应,正确;C项,13个碳应消耗13个O2,20个H消耗5个O2,共为13+5-0.5=17.5,故错;D项,碳碳双键可以与Br2发生加成发生,然后水解酸化,即可得Br-,再用AgNO3可以检验,正确 21世纪教育网
21世纪教育网
反馈“小练习”
4. 解析:(1)n(H)=2n(H2O)=0.4 mol(1分)
nC.=n(CO2)+n(CO)
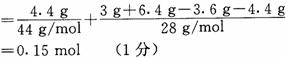
(2)3 g A中,n(H)=0.4 mol,nC.=0.15 mol,
n(O)=2n(CO2)+n(CO)+n(H2O)-2n(O2)
=2×0.1 mol+0.05 mol+0.2 mol-2×0.2 mol
=0.05 mol (1分)
所以,nC.︰n(H)︰n(O)=3︰8︰1
 A的分子式为C3H8O (2分)
A的分子式为C3H8O (2分)
3. D解析:根据燃烧规律,乙醇的分子式C2H6O可变形为C2H4·H2O,由于C2H4·H2O中的H2O不耗氧,故乙醇的耗氧量与乙烯相同。乙醛的分子式C2H4O可变形为C2H2·H2O,由于C2H2·H2O中的H2O不耗氧,故乙醛的耗氧量与乙炔相同。乙酸甲酯的分子式C3H6O2变形为C2H6·CO
2,由于C2H6·CO
2中的CO 2不耗氧,故乙酸甲酯的耗氧量与乙烷相同。乙醇的耗氧量与乙烯相同,而乙酸的的耗氧量与甲烷相同,故乙醇和乙酸的耗氧量不相同,选D 21世纪教育网
21世纪教育网
2. B解析:根据燃烧规律,x+y/4=3,将ABCD中的x、y值代入,只有B符合要求。
考点“逐一突破”
例1:解析:甲烷(CH4)、乙烯(C2H4)、乙炔(C2H2)、苯(C6H6)的(x+y/4)值分别为2、3、2.5、7.5,所以消耗氧气从多到少的顺序的是 D>B>C>A 。
变式训练1 解析:根据烃燃烧通式可知,1molCxHy的耗氧量为x+y/4=5,讨论易知,当x=3,y=8时合理,答案为C。
变式训练2 解析:通过x+y/4或x+y/4-z/2的计算,或将含氧衍生物改写为CxHy·(H2O)n或CxHy·(CO2)m或CxHy·(H2O)n·(CO2)m等形式后的判断,不难发现正确答案为BC。
例2:解析:混合物总质量一定,不论按什么比例混合,完全燃烧后生成CO2的质量保持不变,要求混合物中各组分含碳的质量分数相同。A中碳的质量分数相同,B、C中的两组物质的最简式相同,碳的质量分数也相同,所以答案为D 21世纪教育网
21世纪教育网
变式训练3解析:C6H6 、CH4、C2H6、C3H8的y/x值分别为1、4、3、8/3,所以消耗氧气从多到少的顺序的是 CH4> C2H6> C3H8> C6H6 。
变式训练4、解析:乙烯、聚乙烯的最简式相同,则等质量的乙烯和聚乙烯完全燃烧消耗氧气的物质的量相等,故选C 21世纪教育网
21世纪教育网
例3:解析:要使反应前后压强体积不变,只要氢原子个数可以等于4并保证能使1体积该烃能在4体积氧气里完全燃烧即可。答案:D。
变式训练5解析:反应前后的体积都是10 L,说明反应前后的体积不变,根据烃的燃烧规律,混合烃中的平均氢原子数应为4,只有B.选项的平均氢原子数不可能为4,选B。
变式训练6解析:根据烃的燃烧规律,气态烃(CxHy)完全燃烧后恢复到常温常压时气体体积的变化,燃烧前后体积
△V=1+y/4,则1+y/4=2,解得y=4,故选D。
例4:解析:设三种烃混合物分子平均组成为CxHy
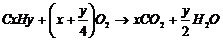 △V
△V
1 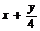 x
x
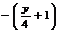
a -2a
 即
即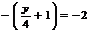 ,解得y=4,即混合物平均组成是H为4。答案应选A.
,解得y=4,即混合物平均组成是H为4。答案应选A.
变式训练7解析:n(H2O)= 3.6g/18g·mol-1=0.2mol,则n(H)= 0.4mol,故混合烃的平均组成为:n(烃):nC.:n(H)= 0.1mol:0.16mol:0.4mol =1:1.6:4,即平均组成为C1.6H4。由于C原子数小于2,故一定有甲烷。由于甲烷分子中的氢原子数为4,平均组成中的氢原子数也是4,故另一种烃中的氢原子数也应该是4,故一定没有乙烷,也不可能有乙炔,故选项AC。
变式训练8、解析:由于n(CO2):n(H2O)>2:1,则nC.:n(H)>1:1,而烷烃的nC.:n(H)<1:1,烯烃的nC.:n(H)=1:1,炔烃的nC.:n(H)>1:1,因此,烷烃与烷烃混合的nC.:n(H)<1:1,不合题意;烷烃与炔烃和烯烃、炔烃混合的nC.:n(H)都有可能大于1:1,而烯烃、烯烃混合的nC.:n(H)= 1:1,不合题意,故选AD。
高考真题“试一试”
1. 解析:n(CaCO3)=0.1mol,m(CO2)=4.4g,mC.=1.2g,m(H2O)=7.1g-4.4g=2.7g,m(H)=0.3g,所以有机物中含氧的质量为:31g-1.2g-0.3g=1.6g,所以n(O)==0.1mol,即nC.∶n(H)∶n(O)=0.1mol∶0.3mol∶0.1mol=1∶3∶1,选项A中C、H、O的原子个数比为1∶3∶1;选项B中的原子个数比为:2∶6∶1;选项C中的原子个数比为:1∶2∶1;选项D中甲醇的原子个数比为:1∶4∶1,丙三醇中的原子个数比为3∶8∶3,其中甲醇的H原子个数大于3,而丙三醇的H原子个数小于3,满足题意要求 21世纪教育网
21世纪教育网
答案:A、D。
5、a:2b
12. 在120℃,101kPa条件下,由H2、CH4、CO组成的混合气体a mL,通入一定量(设为x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧消耗相同条件下氧气的体积也为a mL(即x=a),则原混合气体中CH4的体积分数是 。
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是
,现要测定原混合气体中H2的体积分数,还必须知道相同条件下其它数据可以是
(填选项字母) 21世纪教育网
21世纪教育网
A.前面提供的数据已经足够 B.生成CO2气体的总体积
C.生成H2O(g)的总质量 D.2a mL混合气体的密度
(3)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),求x的取值范围。


基础知识梳理
11.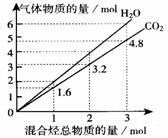 常温下的两种气态烃组成的混合气体完全燃烧后所得到CO2 和H2O的物质的量随混合烃总物质的量的变化如右图所示。
常温下的两种气态烃组成的混合气体完全燃烧后所得到CO2 和H2O的物质的量随混合烃总物质的量的变化如右图所示。
⑴对图中CO2和H2O的量的关系进行分析,得出该混合气体中有且只有一种是烷烃,其理由
。
⑵试根据上图分析推断混合气体的可能组成成份及其体积比,完成下表(可不填满也可增加):
|
组别 |
① |
② |
③ |
④ |
|
|
混合气体的成分 (分子式) |
|
|
|
|
|
|
体积比 |
|
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com