
2、和谐社会是人类自古到今追求的理想和目标,和谐思想是我国古代传统文化的精髓。下列各项中,属于构建和谐社会的思想主张是:①“行之十年,秦民大悦,道不拾遗,山无盗贼,家给人足”②“恭则不悔,宽则得众,信则人任焉,敏则有助,惠则足以使人”③“老吾老以及人之老,幼吾幼以及人之幼,天下可运于掌也” ④“大道之行,天下为公,选贤与能,讲信修睦”( )
A、①②③④ B、①③④ C、①②④ D、②③④
1、齐景公向孔子请教如何为政,孔子说:“国君要像国君的样子,臣子要像臣子的样子,父亲要像父亲的样子,儿子要像儿子的样子。”景公高兴地说:“对呀,要不这样,即使有很多粮食,我还能吃得着吗?”这说明孔子提倡( )
A、仁者爱人,理解和体贴他人 B、克已复礼,人们应贵贱有序
C、政在爱民,国君要严于律已 D、仁政治国,人际关系要和谐
25.(7分)美国计划2015年再次登陆月球,继而在月球上建立基地,给人类登陆火星作准备。为了早日实现梦想,1992年美国进行了第一次利用实际的月球岩石――玄武岩(FeTiO3,钛酸亚铁)来制造氧气的试验。已知FeTiO3被H2还原后,生成Fe、TiO2和水,被C还原后生成Fe、TiO2和CO2。请参与探究,并回答下列问题:
Ⅰ.理论分析
(1)写出FeTiO3在加热时被H2还原的化学方程式: 。该反应中氧化剂为 ,氧化产物为 。
Ⅱ.实验探究
为了测定钛铁矿中可提取氧的质量分数,某研究性学习小组分别设计了以下两套实验装置:
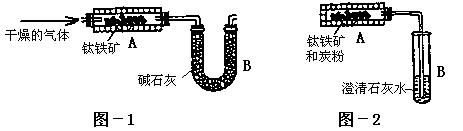
(2)学生甲设想用图-1装置(A为电加热装置)从钛铁矿中提取氧,请写出最简便的实验步骤:__________________________(选填下列数字编号)。
①通入N2;②停止通N2;③通入H2;④停止通H2;⑤加热;⑥停止加热;⑦称取装置B的质量。
(3)学生乙设想用图-2装置(A为电加热装置)从钛铁矿中提取氧,并且认为该方案的意义在于:反应产生的CO2可通过绿色植物的光合作用转化为营养物质,同时产生氧气:6CO2+6H2O
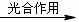 C6H12O6(葡萄糖)+6O2。实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO3的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为:_______________________。
C6H12O6(葡萄糖)+6O2。实验过程中,称得反应前装置A中钛铁矿的质量为ag,炭粉的质量为bg,反应后装置B中产生CaCO3的质量为cg,则钛铁矿中可提取氧的质量分数的表达式为:_______________________。
(4)经专家评审后,认定两个方案都很有意义,但实验设计方面还存在不足之处,例如图-2装置在加热时,生成的CO2不可能全部被澄清石灰水吸收,同时钛铁矿和炭粉在加热时还会产生CO,给实验带来误差。请提出对图-2所示装置应采取的改进措施:_______________________。改进后,实验自始至终需持续向图-2装置A中通入N2的目的是__________________________。
24、(6分)实验室中有甲﹑乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。为确定甲﹑乙两瓶溶液的成分及其物质的量浓度,现操作如下:
①量取25.00mL甲溶液,向其中缓缓滴加乙溶液15.00mL,共收集到CO2气体224mL﹙标况﹚。②量取15.00mL乙溶液,向其中缓缓滴加甲溶液25.00mL,共收集到CO2气体112mL﹙标况﹚。 请回答: (1)根据上述两种不同操作过程及实验数据可判断甲溶液是 (填名称) (2)甲溶液的物质的量浓度为 mol﹒L-1
乙溶液的物质的量浓度为 mol﹒L-1 ﹙忽略CO2在溶液中的少量溶解﹚。
(3)若用类似上述“互滴”的方式。
①将100 mL 3mol/L的NaAlO2溶液逐滴加入50mL12mol/L的HCl溶溶液中,充分反应。
发生反应的离子方程式为_______ 。
②将50mL12mol/L的HCl溶液逐滴加入100 mL 3mol/L的NaAlO2溶液中,充分反应。两种混合方式生成沉淀的量是否相等_______(“相等”“不相等”)
1.1 mol/L氢氧化钠溶液。
B 每次分别取用上述配制的盐酸50 mL跟和氢氧化钠50 mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1) 为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、250mL容量瓶(2个),还缺少的仪器有____ _ _
进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有________ _____
(2)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(3)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
|
实验序号 |
起始温度t1/℃ |
终止温度t2/℃ |
温差(t2-t1) /℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
|
2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容C=4.18×10-3 kJ/(g·℃),则该反应的热化学反应方程式为____________ ______。
23、(5分) 某实验小组设计下列实验
A 分别配制250 mL 1.0 mol/L盐酸跟和250 mL
22、(6分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
O=O |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
498 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”):?SiC_________________Si;SiCl4_____________SiO2。
(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)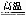 Si(s)+4HCl(g) 该反应的反应热ΔH=______________kJ·mol-1。
Si(s)+4HCl(g) 该反应的反应热ΔH=______________kJ·mol-1。
21、(6分)
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发生如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
该反应常用于检验Mn2+的存在。其特征现象是_______________________,
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3+ MnSO4+ H2SO4- Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
20、(9分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42- 、SiO32- 、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_____________________,
肯定不存在的离子是_____________________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
①H++OH-=H2O ②
③ ④HCO3-+H+=H2O+CO2
⑤
19.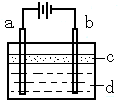 (7分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,
(7分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,
则可制得纯净的Fe(OH)2白色沉淀。已知两
极材料分别为石墨和铁:
⑴a极材料为 ,
电极反应式为 。
⑵电解液d可以是 ,则白色沉淀在电极上生成;电解液d也可以是 ,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
⑶为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com