
14、(1) (2)
(2) ;
;
13、⑴使用催化剂⑵①蒸馏 ②-31⑶氯化氢、氢气
12、(1)①SiHCl3+H2
 Si+3HCl
Si+3HCl
②3SiHCl3+3H2O===H2SiO3↓+H2↑+3HCl 高温下,H2遇O2发生爆炸。
(2)BC
(3)生成白色絮状沉淀,又刺激性气味的气体生成;解释: 与
与 发生双水解反应,
发生双水解反应, + 2
+ 2 +
2H2O ===2NH3·H2O
+ H2SiO3↓
+
2H2O ===2NH3·H2O
+ H2SiO3↓
11、(1)1s22s22p63s23p63d104s24p2 (2)Sn
(3)①直线型 共价键(或σ键与π键)
②Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构
共价键(或σ键)
③熔融时能导电、较高的熔点 (4)配位键
13、工业上用“三氯氢硅还原法”提纯粗硅的工艺流程如下图所示:
 ⑴三氯氢硅的制备原理:Si(s)+3HCl(g)
⑴三氯氢硅的制备原理:Si(s)+3HCl(g)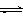 SiHCl3(g)+H2(g) △H=-210 kJ/mol
SiHCl3(g)+H2(g) △H=-210 kJ/mol
工业上为了加快SiHCl3生成速率而又不降低硅的转化率,可以采用的方法是 。
⑵除上述反应外,还伴随着副反应:Si(s)+4HCl(g)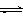 SiCl4(g)+2H2(g) △H=-241 kJ/mol。已知:SiHCl3、SiCl4常温下均为液体。
SiCl4(g)+2H2(g) △H=-241 kJ/mol。已知:SiHCl3、SiCl4常温下均为液体。
①工业上分离SiHCl3、SiCl4的操作方法为 。
②反应SiHCl3(g)+HCl(g) 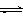 SiCl4(g)+H2(g)的△H= kJ/mol。
SiCl4(g)+H2(g)的△H= kJ/mol。
⑶该生产工艺中可以循环使用的物质是 。
★14、将W g木炭与 同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为
同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为 ,高温下容器中木炭与
,高温下容器中木炭与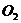 均完全反应后恢复到原温度,压力表的示数为
均完全反应后恢复到原温度,压力表的示数为 ,试求:(1)当W取值发生变化时,反应后压强P也发生变化,P的最大值(以
,试求:(1)当W取值发生变化时,反应后压强P也发生变化,P的最大值(以 表示)是______。
表示)是______。
(2)以W表示满足题设条件的a的取值范围__________。
感悟高考:1、C、2、A
例1:C 例2:B 例3:[0,1] 例4:C 例5:D
课时作业:1-10 :BC、D、A 、AC、B、A 、AC、AD、C 、B
12、硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混O2,可能引起的后果是 。
(2)下列有关硅材料的说法正确的是 (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释 。
11、C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)Ge的原子核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SiO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
④CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
10、美国"9·11"恐怖袭击事件给纽约带来了一场严重的环境灾难--石棉污染,易使吸入石棉者患肺癌,已知石棉是硅酸盐矿物,某种石棉的化学式可表示为:Ca2MgxSiyO22(OH)2,X、Y的值分别为
A.8, 3 B.5, 8 C.3, 8 D.5, 5
9、有一根粗铝含铁和硅杂质,取等质量的样品分别投入足量的稀盐酸和稀氢氧化钠溶液中,放出氢气的质量相等,该粗铝含铁和硅的量的关系正确的是
① 物质的量之比为2∶1② 物质的量之比为3∶1③ 质量之比为2∶1;④质量之比为4∶1 A.②④ B.②③ C.①④ D.只有④
8、关于硅的下列叙述中,不正确的是
A.在自然界中,硅既能以游离态形式存在,又能以化合态形式存在
B.在硅晶体中,含有由共价键形成的硅原子环,其中最小的环上有6个硅原子
C.常温下,硅可与氟气、强碱溶液反应
D.在加热条件下,硅可以与氧气、氯气、硝酸等物质反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com