
2.已知命题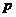 :
: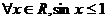 ,则
,则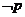 :___________________.
:___________________.
1.设集合 ________.
________.
22、⑴124.2。
⑵C3H8+5O2===3CO2+4H2O;负。
⑶4.2×10-7 mol·L-1。
⑷> ;HCO3-+H2O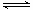 CO32-+H3O+(或HCO3-
CO32-+H3O+(或HCO3- CO32-+H+)。
CO32-+H+)。
HCO3-+H2O H2CO3+OH-、HCO3-的水解程度大于电离程度
H2CO3+OH-、HCO3-的水解程度大于电离程度
21、⑴P(s)+Cl2(g)===PCl3(g);ΔH=-306kJ·mol-1。
⑵PCl5(g)===PCl3(g)+Cl2(g);ΔH=93kJ·mol-1。25%;大于。
⑶两步反应均为放热反应,降低温度有利于提高产率,防止产物分解。
⑷-399kJ·mol-1;等于。
⑸PCl5+4H2O===H3PO4+5HCl。
15、A 16、C 17、AB 18、A 19、A 20、B
14.同质量的氢气燃烧放出的热量远大于汽油
氢的资源丰富 不污染环境
13.4C3H5N3O9=6N2+12CO2+O2+10H2O 324.2Kj
12.P4(固、白磷)= 4P(固、红磷);ΔH=-3970.8kJ/mol
7.A 8.B 9.AC 10.A 11.BC
根据下列叙述回答4-6题
能源可划分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(液)=2H2(气)+O2(气);ΔH=+517.6kJ/mol
4.下列叙述正确的是 ( )
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.焦炉气是一级能源
5.已知2H2(气)+O2(气)=2H2O(液);ΔH=-571.6kJ/mol 。CH4(气)+2O2(气)=2H2O(液)+CO2(气);
ΔH=-890.3kJ/mol。1g氢气和1g甲烷分别燃烧后,放出热量之比最接近 ( )
A.1∶3.4 B. 1∶1.7 C.2.5∶1 D.4.6∶1
6.关于用水制取二级能源氢气,以下研究方法不正确的是 ( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制氢气
B.提高训练
7.已知:乙炔和乙烯燃烧的热化学方程式是2C2H2(g)+5O2(g)== 4CO2(g)+2H2O(l);ΔH=-2600kJ/mol
C2H4(g)+3O2(g)==2CO2(g)+2H2O(l);ΔH=-1411kJ/mol。又已知,乙炔火焰的温度比乙烯火焰的温度高。据此,下列叙述错误的是 ( )
A.每摩尔烃完全燃烧时,放热多的,火焰温度也高
B.烃完全燃烧时,火焰温度高低不仅决定于燃烧的反应热大小
C.同条件等体积乙炔和乙稀完全燃烧,乙炔放的热稍小,耗氧少,产物的物质的量也少
D.每摩尔乙稀完全燃烧,生成气态产物时,放热小于1411kJ
8.在100g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(固)+ O2(气)=CO(气);ΔH=-110.35kJ/mol CO(气)+
O2(气)=CO(气);ΔH=-110.35kJ/mol CO(气)+ O2(气)+CO2(气);ΔH=-282.57kJ/mol
O2(气)+CO2(气);ΔH=-282.57kJ/mol
与这些碳完全燃烧相比,损失的热量是 ( )
A.392.92 kJ B.2489.44 kJ C.784.92 kJ D.3274.3 kJ
9.在同温同压下,下列各组热化学方程式中,Q2>Q1的是( )
A.2H2(气)+O2(气)=2H2O(气);ΔH=-Q1kJ/mol
2H2(气)+O2(气)=2H2O(液);ΔH=-Q2kJ/mol
B.S(气)+O2(气)=SO2(气);ΔH=-Q1kJ/mol
S(固)+O2(气)=SO2(气);ΔH=-Q2kJ/mol
C.C(固)+ O2(气)=CO(气);ΔH=-Q1kJ/mol
O2(气)=CO(气);ΔH=-Q1kJ/mol
C(固)+O2(气)=CO2(气);ΔH=-Q2kJ/mol
D.H2(气)+Cl2(气)=2HCl(气);ΔH=-Q1kJ/mol
 H2(气)+
H2(气)+ Cl2(气)=HCl(气);ΔH=-Q2kJ/mol
Cl2(气)=HCl(气);ΔH=-Q2kJ/mol
10. 已知CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-Q1kJ/mol ,2H2(g)+O2(g)=2H2O(g);
已知CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-Q1kJ/mol ,2H2(g)+O2(g)=2H2O(g);
ΔH=-Q2kJ/mol ,2H2(g)+O2(g)=2H2O(l);ΔH=-Q3kJ/mol ,室温时,取体积比为4∶1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的 热量为( )
A.0.4Q1+0.05Q3kJ B.0.4Q1+0.05Q2kJ C.0.4Q1+0.1Q3kJ D.0.4Q1+0.2Q2kJ
11.已知298K时2SO2(g)+O2(g)==2SO3(g);ΔH=-197kJ/mol。在相同温度下,向密闭容器中通入2molSO2和1molO2达到平衡时放出热量Q1;向另一相同体积的密闭容器中通入1molSO2 和0.5molO2.达到平衡时放出热量Q2 ,则下列关系式正确的是 ( )
A.Q2=Q1/2 B.Q2<Q1/2 C.Q2<Q1<197kJ D.Q1=Q2<197kJ
12.“若是一个反应可以分几步进行,则各步反应的反应热总和与这个反应(在相同条件下)一次发生的反应热相同”,这就是有名的盖斯定律,参照回答。已知白磷和红磷分别在氧气中完全燃烧的热化学方程式:①P4(固、白磷)+5O2(气)=P4O10(固);ΔH=-2983.2kJ/mol
②P(固、红磷)+ O2(气)=
O2(气)= P4O10(固);ΔH=-1738.5kJ/mol
P4O10(固);ΔH=-1738.5kJ/mol
则白磷转化为红磷的热化学方程式是 .由此热化学方程式看出,更稳定的磷的同素异形体是 。
13、硝化甘油(C3H5N3O9)分解时产物为N2 、CO2 、O2和H2O(l),它的分解反应方程式为: 。 已知20℃时2.27g硝化甘油分解放出的热量为15.4kJ,则生成1mol气体伴随放出的热量为 kJ。
14、1mol氢气燃烧时约放热286kJ,而每千克汽油燃烧时约放热46000kJ。氢气被公认是21世纪替代矿物燃料的理想能源。试简述氢气作为能源的三个主要优点: 、 、
C.能力训练
15、白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。
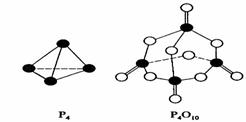
根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b)kJ·mol-1 B(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
16、已知:H2(g)+F2(g)=2HF(g)+270kJ,下列说法正确的是( )
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
17、下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
18、已知H2(g)、C2H4(g)和C2H5OH⑴的燃烧热分别是-285.8kJ·mol-1;-1411.0kJ·mol-1和
-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
 A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1
A.-44.2kJ·mol-1 B.+44.2kJ·mlo-1
C.-330kJ·mol-1 D.+330kJ·mlo-1
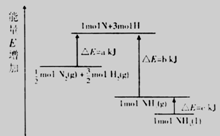
19、化学反应N2+3H2=2NH3的能量变化如右图所示,该反应的热化学方程式是( )
A.N2(g)+3H2(g)=2NH3⑴;ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g);ΔH=2(b-a)kJ·mol-1
C. N2(g)+
N2(g)+ H2(g)=NH3⑴;ΔH=(b+c-a)kJ·mol-1
H2(g)=NH3⑴;ΔH=(b+c-a)kJ·mol-1
D.  N2(g)+
N2(g)+ H2(g)=NH3(g);ΔH=(a+b)kJ·mol-1
H2(g)=NH3(g);ΔH=(a+b)kJ·mol-1
20、下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热
ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
21、红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据)。根据上图回答下列问题:
⑴P和Cl2反应生成PCl3的热化学方程式_________________________________。
 ⑵PCl5分解成PCl3和Cl2的热化学方程式_____________
⑵PCl5分解成PCl3和Cl2的热化学方程式_____________
_______________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_______;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2____α1(填“大于”、“小于”或“等于”)。
⑶工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_____________________________________。
⑷P和Cl2分两步反应生成1molPCl5的ΔH3=_________,P和Cl2一步反应生成1molPCl5的ΔH4______ΔH3(填“大于”、“小于”或“等于”)。
⑸PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________
D.奥赛一瞥
22、北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。已知:C3H8(g) = CH4(g)+HC≡CH(g)+H2(g);ΔH1=156.6 kJ·mol-1
CH3CH=CH2(g) = CH4(g)+HC=CH(g);ΔH2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g) = CH3CH=CH2(g)+H2(g)的ΔH=_____kJ·mol-1
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为___________;放电时,CO32-移向电池的_______(填“正”或“负”)极。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3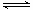 HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
⑷常温下,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是_________________
______(用离子方程式和必要的文字说明)。
第三课时 化学反应中的能量变化 燃烧热和中和热
[例题解析]
1.[解析]要弄清物质的聚集状态与反应热的关系,在相同条件下,物质的量相同的氢气完全燃烧生成液态水时放出的热量大于生成物气态水时放出的热量,因为水的汽化需要吸热
[答案] ⑴Q1<Q2 ⑵Q3=Q1<Q2 ⑶88kJ
2.[解析]应用盖斯定律,将⑴×2-⑵即可得到
. [答案] ΔH=-222kJ/mol
[考题再现]:1、2Fe(s)+3Cl2(g)=2Fe(s);ΔH=-810.4kJ/mol
⑴CH4>H2>CO ⑵H2>CH4>CO
2、N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);ΔH=-641.6kJ/mol
408.815KJ 产物不会污染环境
[针对训练]
1.B 2.A 3.D 4.AC 5.C 6.AC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com