
9.(共16分)
(1)b 、d
(2)①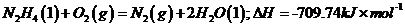
②63:8
(3)1:2
(4)取少量混合后的溶液,向其中加入BaCl2溶液,若生成不溶于稀盐酸的 白色沉淀,则证明发生了氧化还原反应
(5)①S2-发生水解: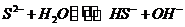 ,其水解程度大于
,其水解程度大于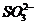 ,所以混合液pH大于NaSO3溶液。
,所以混合液pH大于NaSO3溶液。
②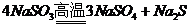
8.(1)HClO4(2)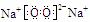 ;离子键和非极性共价键
;离子键和非极性共价键
(3)2I-+
ClO-+ H2O = I2 +
Cl-+
2OH- (4)0.01
9(16分)
(1)下列事实中,能证明亚硫酸的酸性强于氢硫酸(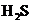 的水溶液)的是___▲___(填字母)。
的水溶液)的是___▲___(填字母)。
a.亚硫酸受热时易分解
b.相同条件下,亚硫酸的导电能力强于氢硫酸
c.亚硫酸溶液可使品红溶液褪色,而氢硫酸不能
d.常温下浓度均为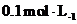 的
的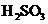 溶液和H2S溶液的pH分别是2.1和4.5
溶液和H2S溶液的pH分别是2.1和4.5
(2)工业上除去高压锅用水中溶解的氧气常用的试剂有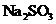 和
和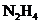 (肼)。
(肼)。
①已知16g液态的肼与氧气反应得到氮气和液态水时,放热354.87kJ,该反应的热化学方程式是__▲__。
②除去等质量的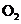 ,所耗
,所耗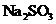 和
和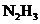 的质量比是__▲__(填最简整数比)。
的质量比是__▲__(填最简整数比)。
(3)向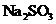 和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是__▲__
和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是__▲__
(4)向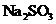 溶液中滴入少量氯水后,用充分混合后的溶液证明二者发生了氧化还原反应的方式(写出操作、试剂、现象、结论)_▲__。
溶液中滴入少量氯水后,用充分混合后的溶液证明二者发生了氧化还原反应的方式(写出操作、试剂、现象、结论)_▲__。
(5)已知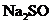 在高温下发生分解,得到两种产物。某同学称取25.2g纯净的
在高温下发生分解,得到两种产物。某同学称取25.2g纯净的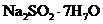 (摩尔质量252
(摩尔质量252 )晶体在高温下隔绝空气加热至恒重,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH。
)晶体在高温下隔绝空气加热至恒重,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH。
①测得溶液的pH大于0.1 mol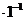 Na2SO3溶液的pH,原因是(结合离子方程式说明)__▲__
Na2SO3溶液的pH,原因是(结合离子方程式说明)__▲__
②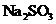 高温分解的化学方程式是__▲__。
高温分解的化学方程式是__▲__。
8. (6分)短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、C
位于同一主族,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最
外层电子数相等。请回答下列问题:
(1)D的最高价氧化物对应水化物化学式为 。
(2)C2B2的电子式为 ,其中含有的化学键类型为 。
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为
(4)用石墨电极电解CD的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体的物质的量为 mol。
7.某温度下,在一个2L的密闭容器中,加人4molA和2molB进行如下反应:3A(g)+2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成重.6molC,则下列说法正确的是B
A.该反应的化学平衡常数表达式是K={[C]4[D]2}/{[A]3[b]2}
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加B,平衡向右移动,B的平衡转化率增大
6.蔗糖酯是联合国国际粮农组织和世界卫生组织推荐使用的食品乳化剂。某蔗糖酯可以由蔗糖与硬脂酸乙酯合成,反应如下:
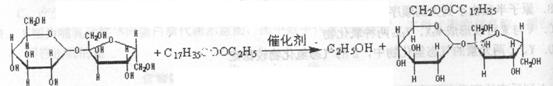
有关说法不正确的是D
A.蔗糖酯可看成是由高级脂肪酸和蔗糖形成的酯
B.合成该蔗糖酯的反应属于取代反应
C.蔗糖分子中含有8个羟基
D.该蔗糖酯在稀硫酸的作用下水解,水解过程中只有硬脂酸和葡萄糖两种产物
5、下列反应的离子方程式正确的是D
A.NaHS水解:HS-+H2O H3O++S2-
H3O++S2-
B.钠与CuSO4溶液反应:2Na+Cu2+==Cu+2Na+
C.向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O==CaCO3↓+2H+
D.澄清石灰水跟盐酸反应:H++OH-==H2O
4.只靠一组镍氢电池驱动,一台试运行的混合动力公交车两年内跑了10万公里。大功率镍氢动力电池及其管理模块,是国家“十五”863计划电动汽车重大专项中一项重要课题。我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为
 LaNi5H6
+ 6NiO(OH)
LaNi5 + 6Ni(OH)2 ,下列说法正确的是D
LaNi5H6
+ 6NiO(OH)
LaNi5 + 6Ni(OH)2 ,下列说法正确的是D
A.放电时储氢合金作正极 B.充电时阳极周围c(OH-)增大
C.充电时储氢合金作阳极 D.放电时负极反应:LaNi5H6+6OH――6e-=LaNi5+6H2O
3.下列叙述一定正确的是B
A.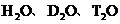 互为同位素
互为同位素
B.pH=1的溶液中,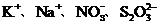 不能大量共存
不能大量共存
C.元素周期表中从上至下同主族元素单质的熔、沸点依次升高
D.乙炔、氢气、铁分别与氯气反应,都会因用量或条件不同而生成不同产物
2.短周期元素X、Y、Z的离子具有相同的核外电子排布,原子半径X大于Z,离子半径Y大于Z,Y与Z可形成常见的离子化合物,则下列说法中不正确的是C
A.原子序数一定是Z>X>Y
B.X、Z两种元素的单质的沸点一定是Z>X
C.Z的最高价氧化物一定能溶于X、Y的最高价氧化物的水化物
D.工业上获得X、Z单质的方法主要是电解
1.化学与生产、生活、社会密切相关。下列有关说法中不正确的是A
A.绿色荧光蛋白质(GFP)是高分子化合物,不可降解,其水溶液有丁达尔效应
 B.五彩缤纷的北京奥运会焰火利用了“焰色反应”原理
B.五彩缤纷的北京奥运会焰火利用了“焰色反应”原理
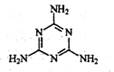
C.三聚氰胺分子结构如右图所示,分子式是C3H6N6
D.氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com