
34.有PH为13的Ba(OH)2、NaOH的混合溶液100ml,从中取出24 ml用0.025mol∕LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸的体积的一半。求:
(1)当滴定到沉淀不再增加时,溶液的PH(设体积可以加和)
(2)计算原混合溶液中Ba(OH)2和NaOH的物质的量浓度。
33.(10分)草酸晶体的组成可用H2C2O4·XH2O表示,为了测定x值,进行如下实验:
(1)称取Wg草酸晶体,配成100.00ml水溶液
(2)取25.00ml所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol/L的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O试回答:(1)实验中不需要的仪器有_____________(填序号)还缺少的仪器有(填名称) .
a托盘天平(带砝码,镊子) b滴定管 c100ml量筒 d100ml容量瓶 e烧杯 f漏斗 g锥形瓶 h玻璃棒 i药匙 j烧瓶
(2)实验中KMnO4溶液应装在 式滴定管中,达到滴定终点的现象是
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得x值会 (偏大、偏小、无影响)
(4)在滴定过程中若用去amol/L的KMnO4溶液Vml,则所配制的草酸溶液的物质的量浓度为 mol/L,由此可计算X的值是 .
(5)若滴定终点读数时俯视,则计算的X值可能会 (偏大、偏小、无影响)
32.

 (8分)(1)(6分)右图分别是温度计、量筒、滴定管的一部分,[来
(8分)(1)(6分)右图分别是温度计、量筒、滴定管的一部分,[来
则:量筒应该是 读数为 mL
滴定管应该是 ,读数为 mL
温度计应该是 ,读数是 ℃
(2)(2分)用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,
下列实验操作会引起测量结果偏高的是 。
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡。
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失
③中和滴定时,锥形瓶内有少量蒸馏水。
④酸式滴定管用蒸馏水洗后,未用标准液洗。
⑤读取滴定管终点读数时,仰视刻度线。
31.(12分)密闭容器中,保持一定温度,进行如下反应:N2(g)+3H2(g) 2NH3(g)。
已知加入1 mol N2和3 mol H2,在恒压条件下,达到平衡时生成a mol NH3[见下表中编号(1)的一行];在恒容条件下,达到平衡时生成b mol NH3[见下表中编号(4)的一行]。若相同条件下,
2NH3(g)。
已知加入1 mol N2和3 mol H2,在恒压条件下,达到平衡时生成a mol NH3[见下表中编号(1)的一行];在恒容条件下,达到平衡时生成b mol NH3[见下表中编号(4)的一行]。若相同条件下,
达到平衡时混合物中各组分的百分含量不变,请填空:
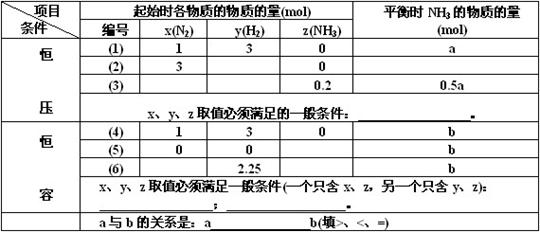
30.(4分)反应aA(g) +bB(g) 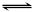 cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
(1)平衡时A与B的转化率之比是_______________。
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b) (c+d) (填 >、=、< 或没关系)。
(3)设定a=2 ,b=1,c=3,d=2,在甲 、乙、丙、丁4个容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是 ,B的转化率由大到小的顺序是
(填容器序号)。
、乙、丙、丁4个容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是 ,B的转化率由大到小的顺序是
(填容器序号)。
29.(6分)(1)在某温度下,H2O的离子积常数为1×10-13,则该温度下
①0.01mol/LNaOH溶液的pH= 。
②100mL 0.1mol/L H2SO4溶液与100mL 0.4mol/L的KOH溶液混合后,pH= 。
(2)①已知一溶液有4种离子:X+、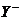 、H+、OH-下列分析结果肯定错误的是( )。
、H+、OH-下列分析结果肯定错误的是( )。
A.CY->CX+>CH+>COH- B.CX+>CY->COH->CH+
C.CH+>CY->CX+>COH- D.COH->CX+>CH+>CY-
②把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的是( )
A.C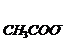 <CNa+
B.C
<CNa+
B.C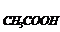 > C
> C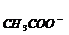
C.2CH+= C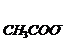 -C
-C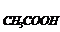 D.C
D.C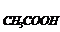 +
C
+
C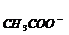
 =0.01mol·L-1
=0.01mol·L-1
28.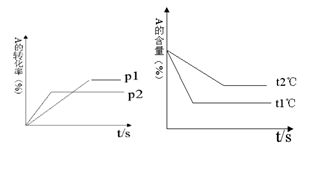 (4分)可逆反应:aA(g)+ bB(g)
(4分)可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2 (填大或小); (2)(a +b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);(4)正反应为 反应。
27.(4分)在一定条件下,可逆反应:mA+nB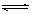 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡 发生移动,则平衡移动的方向是 。
发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
26.(4分)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为________________________。
25、 已知常温常压下饱和CO2溶液的pH值约为3.9,则可以推断盐酸滴定NaHCO3溶液测定其浓度时,适宜选用的指示剂及其终点的颜色变化是( )
A.石蕊,由蓝变红 B.酚酞,红色褪去
C.甲基橙, 由橙变黄 D.甲基橙,由黄变橙
由橙变黄 D.甲基橙,由黄变橙
第Ⅱ卷 (非选择题 共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com