
3.若复数z满足方程 ,则z=
.
,则z=
.
2.不等式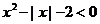 的解集是
.
的解集是
.
1.若直线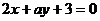 的倾斜角为120°,则a的值是
.
的倾斜角为120°,则a的值是
.
30、实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转化为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。
请回答:
⑴软锰矿制备K2MnO4的化学方程式是 。
⑵K2MnO4制备KMnO4的离子方程式是 。
⑶若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量。
⑷KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的化学方程式是
。
⑸上述制得的KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。
29、⑴配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
⑵称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
D.奥赛一瞥
28、某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
⑴请将Au2O3之外谁反应物与生成物分别填入以下空格内。

⑵反应中,被还原的元素是_______,还原剂是____________。
⑶将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。

⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
27、为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);
方案二:将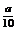 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。请回答下列问题:
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。请回答下列问题:
⑴配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
KMnO4+ FeSO4+ H2SO4= Fe2(SO4)3+ MnSO4+ K2SO4+ H2O
⑵在滴定实验中不能选择 式滴定管,理由是 ;
⑶根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和
;(铁的相对原子质量以55.9计)
⑷若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一 (填“准确”“不准确”“不一定准确”),理由是 ;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
26、氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是(
)
2AlN+3CO合成。下列叙述正确的是(
)
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
25、下列做法中用到物质氧化性的是( )
A.明矾净化水 B.纯碱除去油污
C.臭氧消毒餐具 D.食醋清洗水垢
24、 已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是(
)
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是(
)
A.NaCl、NaClO B.NaCl、NaClO3 C.NaClO、NaClO3 D.NaClO3、NaClO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com