
15. 右图表示可逆反应A(s)+B(g) nC(g);△H=Q,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是 ( )
右图表示可逆反应A(s)+B(g) nC(g);△H=Q,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是 ( )
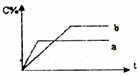 A.若条件为催化剂,则a表示有催化剂,b表示没有催化剂
A.若条件为催化剂,则a表示有催化剂,b表示没有催化剂
B.只控制温度,则a比b的温度高,△H>0
C.只控制压强,则a比b的压强大,n>2
D.由图象可以作出判断,反应一定从正反应方向开始
14.下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是
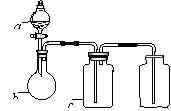 ( )
( )





|
编号 |
气体 |
a |
b |
c |
|
A |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
|
B |
CO2 |
盐酸 |
碳酸钙 |
饱和NaHCO3 |
|
C |
NO |
稀HNO3 |
铜屑 |
H2O |
|
D |
NO2 |
浓HNO3 |
铜屑 |
NaOH溶液 |

13.下列事实能用同一原理解释的是
( )
A.SO2,Cl2均能使品红溶液褪色
B.NH4HCO3晶体、固体I2受热均能变成气体
C.S与Fe、Cu反应均生成低价硫化物 D.ClO-与S2-、H+均不能共存
12.下列推论正确的是 ( )
A.S(g)+O2(g) = SO2(g) △H1,S(s)+O2(g)=SO2(g) △H2;△H1>△H2
B.C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
△H=-57.4kJ/mol
则含20gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7kJ
D.CaCO3(s)=CaO(s)+CO2(g)
△H>0,△s>0,则:该反应任何温度下都能自发进行
11. 阿伏加德罗常数为6.02×1023mol-1,下列说法中正确的是 ( )
A.7.8g Na2O2中含有的离子总数为0.3×6.02×1023
B.1mol NO2气体与水反应生成的NO-3离子数目为6.02×1023
C.0.1molCnH2n+2中含有的C-C键数为0.1×n×6.02×1023
D.标准状况下,2.24L CHCl3含有的分子数为0.1×6.02×1023 
10. 下列对实验现象的解释与结论正确的是 ( )
|
编号 |
实验操作 |
实验现象 |
解释与结论 |
|
A |
向鸡蛋清溶液中,加入(NH4)2SO4溶液 |
有白色沉淀产生 |
蛋白质发生了变性 |
|
B |
向某溶液中加入BaCl2溶液 |
有白色沉淀产生 |
生成难溶于水的BaSO4,该溶液中一定含有SO2-4 |
|
C |
向甲苯中滴入少量浓溴水,振荡,静置 |
溶液分层,上层呈橙红色,下层几乎无色 |
甲苯和溴水发生取代反应,使溴水褪色 |
|
D |
向蔗糖中加入浓硫酸 |
变黑,放热,体积膨胀,放出刺激性气体 |
浓硫酸具有脱水性和强氧化性反应中生成C、SO2和CO2等 |

9.下列说法不正确的是:
( )
A.实验室需用 480mL0.50mol/L的NaOH溶液,现选取500mL容量瓶,则需称取9.6g氢氧
化钠固体溶于水配成溶液
B.用渗析法分离Fe(OH)3胶体和FeCl3溶液的混合物
C.用结晶法提纯混有NaCl的KNO3
D.强酸和强碱反应的中和热的测定实验中,用两个相同的量筒是为了减少实验的误差
8.下列事实中,不能用勒夏特列原理解释的是
( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
7.右图中M、N为含X元素的常见化合物。
则X元素为 ( )
A.Fe或C B.Cu和Fe
C.N或S D.C或Al
5.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的3倍。下列说法正确的是 ( )
A.X的氢化物溶于水显酸性 
B.Y的氧化物是离子化合物
C.Z的氢化物比H2O稳定 
D.X和Z的氧化物对应的水化物都是强酸



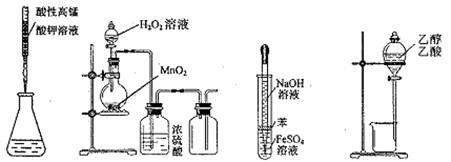 6.下列操作或仪器的选用正确的 ( )
6.下列操作或仪器的选用正确的 ( )








A.滴定FeSO4溶液 B.制取O2
C.制备Fe(OH)2 D.除去乙醇中的乙酸

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com