
19. (7分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,
(7分)由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用右图所示实验装置,
则可制得纯净的Fe(OH)2白色沉淀。已知两
极材料分别为石墨和铁:
⑴a极材料为 ,
电极反应式为 。
⑵电解液d可以是 ,则白色沉淀在电极上生成;电解液d也可以是 ,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
⑶为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为 。
18.只用试管和胶头滴管无法区分的一组试剂是( )
A.KOH溶液和 AlCl3溶液 B.MgCl2溶液和氨水
C.Na[Al(OH)4]溶液和盐酸 D.Na2CO3溶液和盐酸
第Ⅱ卷(非选择题 共46分)
17.我国锑的蕴藏量占世界第一。提取单质锑一般是先在高温下将硫化物转为氧化物,再用碳还原:
2Sb2S3+3O2+6Fe=Sb4O6+6FeS…………………………①
Sb4O6+6C=4Sb+6CO……………………………………②
关于反应①、反应②的说法正确的是( )
A.反应①②中的氧化剂分别是Sb2S3. Sb4O6
B.反应①中每生成3mol FeS 时,共转移6mol 电子
C.反应②说明高温下Sb的还原性比C强
D.每生成4molSb时,反应①与反应②中还原剂的物质的量之比为 4∶3
16.沈城“巨能钙”事件沸沸扬扬,原因在于部分“巨能钙”被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。下列有关说法错误的是( )
A. 双氧水是绿色氧化剂,可作医疗消毒剂,说明H202对人体无害
B. H2O2、Na2O2中都存在非极性共价键
C. H2O2既有氧化性,又有还原性,与KMnO4反应时表现H2O2的还原性
D. H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,和SO2不同
15.将Na2O2投入FeCl2溶液中, 可观察到的现象是( )
A.生成白色沉淀、有气泡产生 B.生成红褐色沉淀、有气泡产生
C.生成浅绿色沉淀、有气泡产生 D.生成黑色沉淀,有气泡产生
14.下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3;②(NH4)2SO3;③Al2O3;④Al(OH) 3;⑤Al;⑥NH4HCO3;
A.①③④⑤ B.①③④⑤⑥ C.②③④⑤⑥ D.全部
13.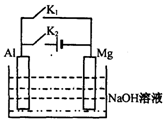 将 Mg 条、 Al 条平行插入一定浓度的 NaOH 溶液中,如图所示用导线连接起来。下列叙述符合事实的是 ( )
将 Mg 条、 Al 条平行插入一定浓度的 NaOH 溶液中,如图所示用导线连接起来。下列叙述符合事实的是 ( )
A.断开 K2,闭合 K1时, Al 电极反应
为: Al+ 4OH-一3e一===AlO2-+ 2H2O
B.断开 K2,闭合 Kl 时,由于 Mg 比 Al 活泼,
故 Mg失去电子被氧化成 Mg2+
C.断开 K1,闭合 K2时,电子由 Mg 向 Al 流动
D.断开 Kl ,闭合 K2时,溶液中立即会有白色沉淀析出
12. 已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1

 CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1

 现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是( )
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是( )

 A.1∶1 B.1∶3
A.1∶1 B.1∶3 
 C.1∶4
D.2∶3
C.1∶4
D.2∶3
11.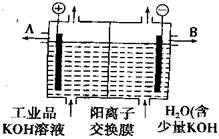 氢氧化钾是重要的工业产品,工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜电解提纯,电解槽内装有阳离子交换膜(只允许阳离子通过),其工业原理如下图所示:
氢氧化钾是重要的工业产品,工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜电解提纯,电解槽内装有阳离子交换膜(只允许阳离子通过),其工业原理如下图所示:
下列有关说法中错误的是( )
A.该电解槽的阳极反应式为4OH--4e-=2H2O+O2↑
B.通电开始后,阴极附近溶液的PH会增大
C.K+可从阳极区进入阴极区和OH-组成KOH
D.除去杂质后的KOH溶液从液体出口A导出
10.羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原,现用15.00mL 0.049 mol/L羟胺的酸性溶液与足量硫酸铁溶液反应(Fe3+转变为Fe2+)。生成的Fe2+ 恰好与24.50mL 0.020 mol/L KMnO4酸性溶液完全作用:
2KMnO4 + 6FeSO4 + 4H2SO4 = 3Fe2(SO4)3 + K2SO4 + 4H2O + 2MnO2,则上述反应中羟胺的氧化产物为( )
A.N2 B.N2O C.NO D.NO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com