
21.(18分)纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数。图中:①空气②某溶液③纯碱④某溶液⑤碱石灰
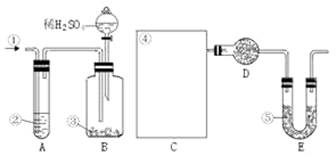
其实验步骤是:a.按右图所示,组装好实验仪器,并检查其气密性。b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g)。c.准确称量一定量的纯碱(设为n g),并将其放入广口瓶内。d.从分液漏斗中缓慢滴入一定量的稀硫酸,并从“①”处缓慢鼓入空气,直到B容器中不再产生气体为止。e.准确称量干燥管D的总质量(设为m2 g)。
根据上述实验回答下列问题:
(1)该实验进行到操作d时,要缓缓鼓入空气,其作用是____________________ 。装置A中盛装的液体“②”应选用________________,装置A的作用是________________,如果撤去装置A,直接向B中缓缓鼓入空气,则会导致实验测定结果(填“偏大”“偏小”或“不变”)________________。
(2)在空白格内画出装置C及试剂④是__________ ;装置C的作用是________________;如果撤去装置C,则会导致测定结果________________(填“偏大”、“偏小”或“不变”)
(3)根据此实验,计算纯碱中Na2CO3的质量分数的数学式为________________(用m1、m2、n表示)
(4)装置E的作用是________________________。
会昌中学2010-2011学年第一学期第一次月考试题答案及评分标准
高三化学
20.(8分)某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO47H2O)和胆矾晶体。其实验方案如下:
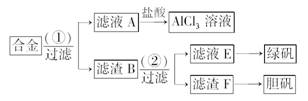
(1)所加试剂①、②分别是__________________。
(2)从滤液E中得到绿矾晶体的实验操作是
________________________________________________________________________;
从滤渣F制取胆矾的第一步操作最好采用
________________________________________________________________________。
(3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由________________________________________________________________________
________________________________________________________________________。
19.(8分)有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后在滤液中滴入AgNO3溶液,有白色沉淀生成;:]
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
根据上述实验,这包粉末中一定不含有的离子是 ;肯定含有的离子是 ;不能确定是否含有的离子是 ,可通过 来进一步确定该离子。
18.(4分)酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式
;
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)
= : : : .(要求写出最简比)
17.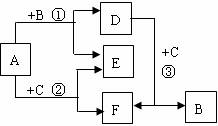 (14分)A-F都是中学化学常见物质,它们间的相互转化关系如下图所示,其中A、D、F是化合物,E是非金属单质。
(14分)A-F都是中学化学常见物质,它们间的相互转化关系如下图所示,其中A、D、F是化合物,E是非金属单质。
⑴若B、C、E都是同主族非金属单质,则B、C、E三者的 氧化性由强到弱的顺序是(用化学式表示) ; 反应③的离子方程式是 。
⑵若B、C都是化合物,则E的分子式是 ,反应①中每生成1molE转移电子的物质的量是 ,该反应的化学方程式并标出电子转移的方向和数目是: 。
⑶若B是日常生活中常见金属单质,C是非金属单质,且反应①②③均在高温下进行。则E的分子式是 ,反应①的化学方程式是
16.要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时最佳顺序为
①加入足量氯水;②加入足量KMnO4溶液;③加入少量NH4SCN溶液
A.①③ B.②③ C.③① D.①③②
15.下列化学实验事实及其解释都正确的是
A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜熔点高于铝
B.将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4强
C.FeCl3溶液可以腐蚀线路板上的Cu,说明Fe的金属活动性大于Cu
D.将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性
14. 将Mg、Cu组成的混合物26.4 g,投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96 L,向反应后的溶液中加入过量的5mol/L的NaOH溶液300 mL,金属离子完全沉淀。则形成沉淀的质量是
A.32.8g B.46.8g C.53.6g D.63.8g
13.一定量的质量分数为14%的KOH溶液,若将其蒸发掉100 g水后,其质量分数为28%,体积为80 mL,则浓缩后的KOH的物质的量浓度为
A.2.2 molL-1 B.4 molL-1 C.5 molL-1 D.6.25 molL-1
12.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是
A.该反应中Fe2+是还原剂,O2是还原产物
B.4 mol Na2O2在反应中共得到8NA个电子
C.Fe(OH)3是氧化产物,每生成4 mol Fe(OH)3反应过程中共转移电子6 mol
D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com