
5.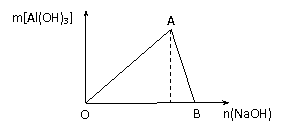 [江苏省前黄高级中学09届上学期高三化学第二次周练卷 ](10分)图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答:
[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ](10分)图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答:
(1) A点时已参加反应的AlCl3和 NaOH的物质的
量之比为1比 。
(2) OA段曲线所表示的反应的离子方程式是
___________________。AB段曲线所表示的反应的离子方程式是___________________。
 (3)
B处溶液中存在的浓度最大的离子是 (填离子符号)。向B处生成的溶液中通入二氧化碳,可见到的现象是
。
(3)
B处溶液中存在的浓度最大的离子是 (填离子符号)。向B处生成的溶液中通入二氧化碳,可见到的现象是
。
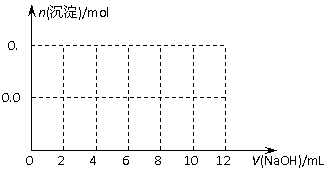
(3) 向含有0.1mol NH4Al(SO4)2溶液中逐滴加入5mol·L-1NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
答案.(1) 3(1分);
(2) Al3++3OH-=Al(OH)3↓(2分);Al(OH)3+OH-=AlO2-+2H2O(2分);
(3) Na+(1分);生成白色沉淀(1分)。
 (4) (3分)
(4) (3分)
4.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ](12分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
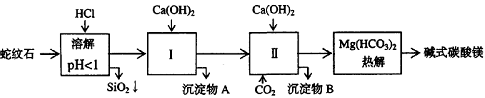
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________。
(2) 进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)Ca(OH)2不能过量, w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
若Ca(OH)2过量可能会导致 溶解、 沉淀。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(3) 从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4) 物质循环使用,能节约资源。上述实验中,可以循环使用的物质是______________(填写物质化学式)。
(5) 现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):①样品称量 ②高温分解 ③______________________________
④_____________________________ ⑤MgO称量
(6) 18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________、b=_________、c=_________。
答案.、(12分)(1)Fe3+ Al3+;(2)Al(OH) 3、Mg(OH)2;(3)NaOH,过滤、洗涤、灼烧;
(4)CO2;(5)③测出CO2的质量;④测出水蒸汽的质量;(6)3、1、3。
3.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ](12分);图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:
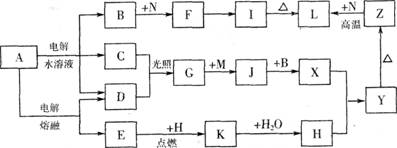
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。
(2) Z→L反应的名称是 ,K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式 。
答案. (1)阳离子交换膜(2分);
(2)(4分);铝热反应, 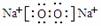
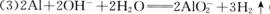 (2分);
(2分);
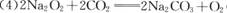 (2分);
(2分);
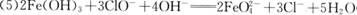 (2分);
(2分);
2.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ](10分)平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g。试通过计算推测该碱式盐的化学式。
答案.、(10分)n(CO32-)=0.005mol(2分),n(OH-)=0.08mol(2分),
n[Mg(OH)2]==0.03mol(2分),n(Al3+)=001mol(2分),
碱式盐中含有结晶水(1分),碱式盐的化学式为:Al2Mg6(OH)16CO3·4H2O(1分)。
1. [江苏省前黄高级中学国际分校09姐上学期综合练习三]最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺。这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等。该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气。合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜。下列关于铝、镓的说法正确的是
[江苏省前黄高级中学国际分校09姐上学期综合练习三]最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺。这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等。该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气。合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜。下列关于铝、镓的说法正确的是
A.铝的金属性比镓强 B.铝的熔点比镓低
C.Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应
D.铝、镓合金与水反应后的物质可以回收利用冶炼铝
6、范围讨论计算是近几年高考题中出现的一种新题。此类题目融化学原理、元素化合物知识、数据分析、逻辑推理于化学计算之中,技巧性强,方法灵活,因而是高考的热点和难点。范围讨论计算所依据的化学原理是反应物之间相对含量不同而产物不同(如H2S与O2反应、Na2O2与NaHCO3共热、Cl2与NH3反应等),所以,此类题目实际上是过量计算的演化和延伸。范围讨论计算的解题方法思路是:
(1)写方程式、找完全点。即写出因反应物相对量不同而可以发生的化学反应方程式,并分别计算找出二者恰好完全反应时的特殊点。
5、无数据计算题较特殊,字里行间无任何数据,却要进行计算。这类题型在一定程度上增大了解题的难度和迷惑性,但只要掌握了它的解法,并不难。无数据型计算题的常用解法有等量法、假设法和推理法等。
数据缺省型题目的特点是:构成计算要素的已知量缺省,要求学生根据计算要求补充这一缺省量,然后进行有关计算。数据缺省型计算题是近几年国家命题组开发出来的成功计算题型。此类试题对考查学生逻辑思维能力及学习潜能特别有效。
4、多步反应的计算应先写出有关反应的化学方程式,然后找出起始物质与最终物质之间的关系,再用关系式进行计算。此类题目往往涉及物质纯度、转化率、利用率、产率等概念。
3、判断反应物中有一种过量的化学计算题出现较多,其判断的方法因题型(即所给已知条件)不同而不同。常见的方法有常规方法、极端假设法、产物逆推法等。因此判断的方法灵活多变,具有一定的难度。
2、混合物反应的计算是化学计算中的一种最基本的类型。混合物可以是固体、气体或溶液,解题过程中必须仔细审题,理清各物质之间量的关系,必要时可采用图示或简捷的化学用语表示。二元混合物是混合物计算中最重要也是最基本的一种类型,其一般解题思路是:设两个未知数,然后根据有关反应的化学方程式中物质的量关系,列出二元一次方程组求解。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com