
3.重点掌握根据氧化还原的原理进行有关铁及其化合物的相关计算。培养分析、综合、归纳问题的能力和解决问题的能力。
2.掌握Fe2+、Fe3+的有关计算、除杂、鉴别、分离等方面的应用。
1.掌握Fe2+、Fe3+的相互转化关系
12.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是[A]
A.3摩/升HCl B.4摩/升HNO3 C.8摩/升NaOH D.18摩升H2SO4
11.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是[C]
A.熔融的MgO不导电 B.MgO分子间作用力很大
C.MgO熔点高 D.MgO属原子晶体
10.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]某溶液中含三种离子,加入过量氨水有沉淀生成,过滤后滤液中加过量盐酸,又有沉淀生成,再过滤,滤液中加入过量Na2CO3溶液,仍有沉淀生成,原溶液中含有的离子可能是[AD] A.Ag+、Fe2+、Ca2+ B.Al3+、Mg2+、Ba2+ C.Ca2+、Fe2+、Ba2+ D.Ag+、Mg2+、Ba2+
9.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是[A]
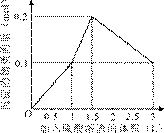
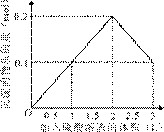
A B
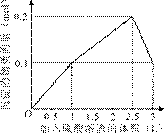
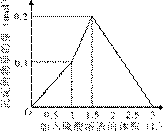
C D
8.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原和物中K+的物质的浓度为[B] w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
A.0.2mol/L B.0.25mol/L C.0.45mol/L D.0.225mol/L
7.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ]将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L。向溶液中逐滴加入浓度为amol·L-1的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L。将溶液蒸干灼烧得固体w2g。下列关系式中不正确的是[A]
A.35.5aV2=w2-w1 B.23n(Na)+27n(Al)=w1
C.n(Na)+3n(Al)=2V1/22.4 D.58.5n(Na)+51n(Al)=w2
6.[江苏省前黄高级中学09届上学期高三化学第二次周练卷 ](18分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。w.w.w.k.s.5.u. c.o.m
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是 。
[实验步骤]
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01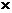 105Pa)的体积。
105Pa)的体积。
[问题讨论]
(1)同学们拟选用下列实验装置完成实验:


①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是 。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为__________mL。
答案.[方案一]2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)(1)97mL(2分)(2)偏高(1分)
[方案二](1)①EDG(2分)
②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大(2分)③ACD(3分)
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。(4分) ②V1-V2 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com