
|
1. 2. |
考点1:Fe3+、Fe2+、Fe(OH)2 与 Fe(OH)3的转化
[例1] 向amolCuCl2和bmolFeCl3的混合溶液中加mg铁粉,(1)若溶液中有Fe3+、Fe2+、Cu2+,则m和a、b的关系为0<m<28b,(2)若溶液中仅有Fe2+和Cu2+,则m和a、b的关系为28b≤m<28(2a+b),(3)若溶液中只有Fe2+,则m和a、b的关系为 m≥28(2a+b),
[感悟]:
考点2:Fe3+、Fe2+的检验
[例2] 老师在足量的稀氯化亚铁溶液中加入1-2滴溴水,振荡,溶液变为浅黄色。 (1)甲学生认为这不是发生化学反应所致,使溶液变黄的物质是 溴,乙学生认为这是化学反应所致,使溶液变黄的是Fe3+。 (2)老师提供如下试剂:
A、酸性高锰酸钾溶液B、四氯化碳 C、碘化钾溶液D、硫氰化钾溶液
请你验证,乙同学的推断是正确的,你选择的试剂是(填编号) D ,实验中观察到的现象是溶液立即出现血红色。
(3)根据上述实验的事实推测,若在溴化亚铁溶液中通入氯气,先后发生的反应分别是(用离子方程式表示)2Fe2++Cl2=2Fe3++2Cl- 2Br-+Cl2=Br2+2Cl-。
[感悟]:
5.忽视铁单质与强氧化性物质反应时,也有生成二价铁化合物的可能性。反应中若铁为足量,最终铁元素将以二价铁形式存在,因为2Fe3++Fe=3Fe2+。
4.忽视亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,而也可能含有Fe2+。
3.注意FeCl3、Fe2(SO4)3的水溶液蒸干所得剩余固体的区别。
FeCl3溶液加热浓缩时,因Fe3+水解和HCl的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe2O3固体。但Fe2(SO4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。
2.过量的Fe与硝酸作用,或在Fe和Fe2O3的混合物中加入盐酸,要注意产生的Fe3+还可以氧化单质Fe这一隐含反应:Fe+2Fe3+=3Fe2+。
1.NO3-与Fe2+在酸性条件下,不能共存。
3.下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将杂质除去:
|
物质 |
杂质 |
试剂或方法 |
化学方程式 |
|
(1)FeCl3溶液 |
FeCl2 |
Cl2和H2O2 |
2FeCl2 +Cl2 = 2FeCl3 |
|
(2)FeCl2溶液 |
FeCl3 |
Fe粉 |
2FeCl3 + Fe = 3FeCl2 |
|
(3)FeSO4溶液 |
CuSO4 |
Fe粉 |
Cu2++ Fe = Fe2++ Cu |
|
(4)Fe2O3 |
Al2O3 |
NaOH溶液 |
2NaOH+ Al2O3=NaAlO 2+H2O |
|
(5)Fe2O3 |
Fe(OH)3 |
加热 |
2Fe(OH)3
△==Fe2O3+3H2O |
|
(6)Fe(OH)3 |
Al(OH)3 |
NaOH溶液 |
NaOH+ Al(OH)3=NaAlO 2+2H2O |
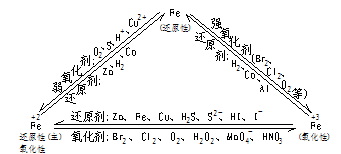 总结:
总结:
注意:
2.Fe3+与Fe2+的鉴别:
①观察法:其溶液呈棕黄色者是Fe3+,呈浅绿色者是Fe2+
②H2S法:通入H2S气体或加入氢硫酸,有淡黄色沉淀析出者是Fe3+ ,无明显变化的是Fe2+。
③KSCN法:加入可溶性硫氰化物溶液,呈血红色者是Fe3+,无明显变化的是Fe2+。离子方程式为:Fe3++SCN-=[Fe(SCN)]2+
④苯酚法:加入苯酚溶液,呈紫 色者是Fe3+,无明显变化的是Fe2+。
⑤碱液法:分别通入氨气或加入氨水或碱液,生成红褐色沉淀者是Fe3+;生成白沉淀,并迅速变为灰绿色,最终变成红褐 色者是Fe2+。
⑥淀粉KI试纸法:能使淀粉KI试纸变蓝者Fe3+,无明显变化的是Fe2+。离子方程式为:
2Fe3+ +2I-=2Fe2++I2
⑦铜片法:分别加入铜片,铜片溶解且溶液变为 蓝色者是Fe3+,无明显变化的是Fe2+。
⑧KMnO4法:分别加入少量酸性KMnO4溶液,能使KMnO4溶液的紫色变浅的是Fe2+,颜色基本无变化的是Fe3+。离子方程式为:5Fe2+ +MnO4-+8H+= 5Fe3++Mn2++4H2O
Fe3+、Fe2+、Fe(OH)2 与 Fe(OH)3
1.Fe3+与Fe2+的相互转化:
2FeCl2 +Cl2 = 2FeCl3_ 6FeCl2 +3Br2 = 4FeCl3+2FeBr3
4Fe(OH)2 +2H2O +O2= 4Fe(OH)3
2FeCl3 +Cu = 2FeCl2+ CuCl2 2FeCl3 + Fe = 3FeCl2
2FeCl3 + H2S = 2FeCl2 +2HCl+S 2FeCl3 +SO2+ 2H2O = FeCl2+H2SO4+2HCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com