
24.金属锡(Sn)的纯度可以通过下列方法分析:将试样溶于盐酸,反应的化学方程式为:Sn+2HCl=SnCl2+H2,再加过量的FeCl3溶液,反应为:SnCl2+2FeCl3=SnCl4+2FeCl2,最后用已知浓度的KMnO4(含稀硫酸)滴定Fe2+,现有0.613g金属锡样品,照上述各步反应后 ,共用16mL0.100mol/LKMn04溶液.
(1)写出FeCl2和KMnO4反应的方程式。
(2)求试样中锡的质量分数.
23.为熔制钾玻璃准备如下熔料:360g重的石英砂,67.2g重的苛性钾和88.8g重的熟石灰 .假定这些熔料不含杂质.
(1)计算在制得的钾玻璃中各氧化物的质量分数.
(2)用氧化物的形式表示钾玻璃的组成.
22.以硅酸钠为原料制取125g硅胶(含水4%的二氧化硅),理论上需硅酸钠多少克?
21.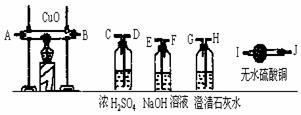 水煤气是一混合气,它的主要成分是CO、H2,并有少量的CO2和水蒸气。请用下列装置设计一个实验,验证水煤气中含有CO和H2
水煤气是一混合气,它的主要成分是CO、H2,并有少量的CO2和水蒸气。请用下列装置设计一个实验,验证水煤气中含有CO和H2
(1)连接上述装置的正确顺序是(填仪器接口处的字母) ;
(2)确认混合气体中含有氢气的实验现象是
。
20.某灰色粉末状固体A与NaOH溶液共热放出无色无味气体B,A在氧气中燃烧生成无色固体C,C与氢氟酸反应又生成气体D,D通入水中可与水反应生成白色沉淀E,E用适量NaOH溶液处理可得溶液F,在F溶液中通入CO2则E重新析出。由此可以推断:A B C
D E F 。
19.除去下列物质中的杂质,(括号内的物质为杂质)。写出所加试剂或采用的方法,并写出有关反应的化学方程式:
|
物质 |
试剂(或方法) |
有关反应的化学方程式 |
|
CO(CO2) |
|
|
|
CO2(CO) |
|
|
|
NaHCO3溶液(Na2CO3) |
|
|
|
Fe2O3(SiO2) |
|
|
18.向碳酸钾溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止。在反应过程中,溶液中的HCO3-离子浓度的变化趋势是( )
A.逐渐增大 B.逐渐减小
C.先逐渐增大,后逐渐减小 D.无法判断
17.下列有关碳和硅氧化物的说法中,正确的是( )
A.二氧化硅的水溶液显酸性,所以,二氧化硅是酸性氧化物
B.二氧化碳通入水玻璃可得到原硅酸,说明碳酸的酸性比硅酸强
C.高温时二氧化硅与纯碱反应放了二氧化碳,所以硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,因此,它不能溶于任何酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com