
20.X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是

A.该反应热化学方程式为X(g) +3Y(g) 2Z(g) △H= ―(E2―E1)
B.若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线
C.该反应达平衡后,若升高温度,Y的转化率降低
D.图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线
19.下列溶液中微粒的物质的量浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2 c(H2CO3)
C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3)
D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(NH4+)>c(Na+)>c(SO42-)>c(OH-)=c(H+)
18.燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是
A.固体氧化物燃料电池 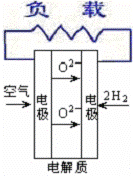 |
B.碱性燃料电池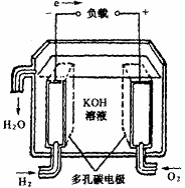 |
C.质子交换膜燃料电池 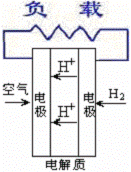 |
D.熔融盐燃料电池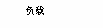  |
17.绿原酸是咖啡提取液的成分之一,其结构如图所示。下列关于绿原酸的说法正确的是
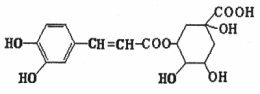
A.分子中所有碳原子可能共面
B.一定条件下,1 mol该物质最多与4 molNaOH反应
C.水解产物都可以与FeCl3溶液发生显色反应
D.1 mol该物质最多与6 mol浓溴水反应
16.短周期元素X、Y、Z和W 的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19, X和Y元素原子的原子序数比6∶7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A.X单质可以通过铝热法获得 B.Y的氧化物是良好的半导体材料
C.Z的氢化物比W的氢化物更稳定
D.X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
15.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M。
关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成7.5 g As,还原剂失去的电子为0.3 mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
14.化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子法”表示的化学方程式
正确的是
A.2Na2O2+2H218O=4NaOH+18O2↑
B.CH3COOH+CH3CH218OH→CH3COOCH2CH3+H218O
C.5H218O2+2KMnO4+3H2SO4=518O2↑+K2SO4+2MnSO4+8H2O
D.K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
13.甲、乙、丙、丁都是第三周期元素形成的单质,下列叙述正确的是
A.1mol单质甲完全燃烧生成的氧化物与热烧碱溶液反应,最多消耗12 mol NaOH,甲的分子结构为正四面体。
B.1mol单质乙完全燃烧生成的氧化物与烧碱溶液反应,最多消耗1 mol NaOH,乙的氧化物的熔点较低。
C.1mol单质丙完全燃烧生成的氧化物与烧碱溶液反应,最多消耗16 mol NaOH,晶体丙是原子晶体。
D.1mol单质丁完全燃烧生成的氧化物与烧碱溶液反应,最多消耗2 mol NaOH,丁是良好的半导体。
12.关于下列图示的说法中正确的是
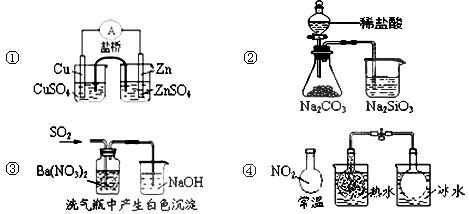
A.图①能组成Zn、Cu原电池 B.图②能证明非金属性Cl>C>Si
C.图③白色沉淀为BaSO3
D.图④说明反应2NO2 N2O4(无色)△H>0
N2O4(无色)△H>0
11. 以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+ SO2(l) SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.自离解的存在,说明SO2是离子化合物
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+ SO2(l) SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是
A.自离解的存在,说明SO2是离子化合物
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数 C.该滴定反应可以表示为:SO32-+ SO2+ = 2SO2 D.可通过导电能力变化来判断是否到达滴定终点
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com