
4、下列实验设计方案肯定能获得成功的是 ( )
A、用1mol/L的盐酸与MnO2反应制取氯气
B、用湿润的淀粉碘化钾试纸鉴别二氧化氮和溴蒸汽
C、用10mL量筒量取8.50mL浓硫酸用于配制一定物质的量浓度的稀硫酸
D、用湿润的有色纸条鉴别氯化氢和氯气
3、下列推断正确的是( )
A、SiO2是酸性氧化物,能与NaOH溶液反应
B、Na2O, Na2O2组成元素相同,与CO2反应产物也相同
C、CO,NO,NO2都是大气污染气体,在空气中都能稳定存在
D、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液显红色
2、在下列各溶液中,离子一定能大量共存的是 ( )
A、强碱溶液中:K+,Al3+,Cl-,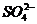 B、含有0.1mol/L Fe3+的溶液中:K+,Mg2+,I-,
B、含有0.1mol/L Fe3+的溶液中:K+,Mg2+,I-,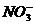
C、含有0.1mol/L Ca2+溶液中:Na+,K+,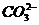 ,Cl-
,Cl-
D、室温下PH=1溶液中:Na+,Fe3+,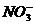 ,
,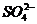
1、用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是( )
①幕布的着火 点升高
②幕布的质量增加 ③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
点升高
②幕布的质量增加 ③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A、①② B、③④ C、①④ D、②④
24. (6分)已知Ksp(AgCl)=1.8×10-1 0,Ksp(Ag2CrO4)=1.9×10-12,现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种离子先沉淀?
(2)当刚出现Ag2CrO4沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离).
23. (16分)草酸(H2C2O4)是一种有机二元弱酸,水溶液中草酸的存在形态有三种,各形态的浓度分数α(H2C2O4-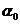 ,HC2O4--
,HC2O4--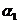 ,C2O42--
,C2O42--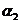 )随溶液pH变化的关系如图所示:
)随溶液pH变化的关系如图所示:
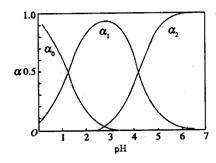 (1)草酸钠溶液中,
(1)草酸钠溶液中,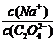 2(填“>”
“=” 或“<”);往该溶液中滴入氯化钙溶液后,
2(填“>”
“=” 或“<”);往该溶液中滴入氯化钙溶液后,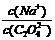 增加,可能的原因是 。
增加,可能的原因是 。
(2)往草酸钠溶液中滴稀盐酸,pH=5时溶液中存在的阴离子有 ,pH=3时,以上两种物质发生的主要反应的离子方程式为 。
(3)菠菜富含草酸,菠菜不能与牛奶、豆腐一起食用的原因是 。
(4)将适量草酸亚铁(FeC2O4·H2O)粉末加入试管中,在酒精灯上边加热边摇动,发生剧烈反应,产生的气体可使燃着木条熄灭,同时生成黑色粉末。反应即将结束时,将所得的黑色粉末撒在石棉网上,便会立即自燃起来。
草酸亚铁粉末受热分解的化学方程式为 ,
自燃的原因是 。
(5)下表为几种酸对铁锈及锅炉水垢的溶解性比较:
|
酸 |
铁锈[Fe(OH)3]溶解量/g |
水垢(CaCO3)溶解量/g |
|
盐酸 |
0.7911 |
全溶 |
|
磷酸 |
0.1586 |
微溶 |
|
草酸 |
0.7399 |
0.0036 |
|
醋酸 |
0.1788 |
0.1655 |
下列说法正确的有 (选填字母)。
A.同物质的量浓度时,酸性越强的酸除铁锈效果越好
B.草酸除水垢效果差的原因是因为草酸酸性太弱
C.铁锈或水垢在酸中的溶解性与酸根离子的性质可能有关
D.硫酸除铁锈和水垢的效果都好
22. (8分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A、F两元素的原子核中质子数之和比C、D两元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物发生反应,完全反应后消耗后者的物质的量为__________。
(2)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为__________。
(3)单质B的燃烧热a kJ/mol。由B、C二种元素组成的化合物BC14g完全燃烧放出b kJ热量,写出单质B和单质C反应生成BC的热化学方程式:_________________。
(4)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1mol A2C和1mol BC、2mol A2C和2mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是__________
A.达到平衡所需要的时间:Ⅰ>Ⅱ
B.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>Ⅱ
D.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
21. (12分)填写下列物质溶于水后的电离方程式:
(1)HI
(2)Ca(OH)2
(3)Fe(OH)3
(4)H2SO3
(5)Na2HPO4
(6)BaSO4
20. (8分)25℃时,若体积为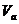 、pH=a的某一元强酸与体积为
、pH=a的某一元强酸与体积为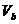 、pH=b的某一元强碱混合,恰好中和,且已知
、pH=b的某一元强碱混合,恰好中和,且已知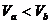 和a=0.5b,请填写下列空白:
和a=0.5b,请填写下列空白:
(1)a值可否等于3(填“可”或“否”)______________,其理由是__________________
________ ____________________。
(2)a值可否等于5(填“可”或“否”)___________,其理由是_____________________
_______________________________ ___________。
(3)试确定a的取值范围_________________________________。
19. (6分)有一种pH为12的NaOH溶液100 mL,要使它的pH降到11,
(1)如果加入蒸馏水,应加____________mL;(溶液总体积允许相加。下同)
(2)如果加入pH=10的NaOH溶液,应加______________mL;
(3)如果加入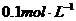 的盐酸,应加__________________mL。
的盐酸,应加__________________mL。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com