
4. 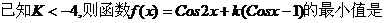 ( )
( )
A.1 B.-1 C.2k+1 D. -2K+1
2.下列有关命题正确的是( )
A.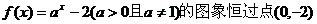
B.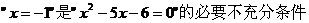 。
。
C.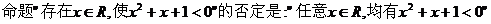
D.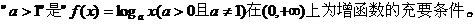
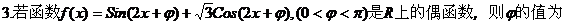
A.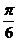 B.
B. 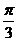 C.
C.
 D.
D.
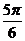
1.已知Cos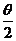 =
=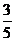 、Sin
、Sin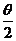 =-
=-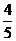 ,则角
,则角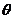 的终边落在直线( )上。
的终边落在直线( )上。
A.7x+24y=0 B.7x-24y=0 C.24x+7y=0 D.24x-7y=0
21、(13分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。a、KSCN溶液和氯水 b、铁粉和KSCN溶液 c、浓氨水 d、酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
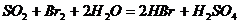
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 _______
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可以含有H2和Q气体。为此设计了下列探究试验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是 。
(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28mLH2),除可用测量H2体积的方法外,可否选用质量称量的方法?作出判断并说明理由
。
20、(10分)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ、从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ、将FeSO4·7H2O配制成溶液。
Ⅲ 、FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ、将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ、煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3 在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+ ,该反应的离子方程式是
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用
(3)Ⅲ中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)Ⅳ中,通过检验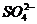 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验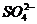 的操作是
的操作是
19、( 12分)已知A为液态化合物,B为固态单质,J为淡黄色固体,三者都是中学化学中常见的物质,它们之间相互反应以及生成物之间的关系如下图所示:
12分)已知A为液态化合物,B为固态单质,J为淡黄色固体,三者都是中学化学中常见的物质,它们之间相互反应以及生成物之间的关系如下图所示:
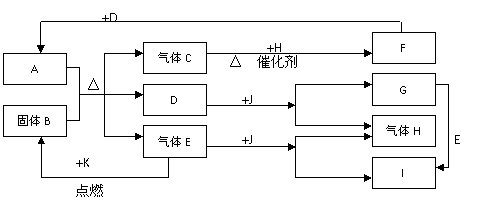
请回答下列问题:
(1)其中物质C是大气污染物之一,该物质导致的环境危害有 (写一个)
(2)F,G,H,J,K代表的物质的化学式分别是F G H
J K
(3)写出A与B反应的化学方程式

(4)饱和I溶液中通入过量的气体E出现的现象是
其反 应的离子方程式是
。
应的离子方程式是
。
18.(8分)在一定条件下,某些化学反应可用下列框图表示,请回答下列问题
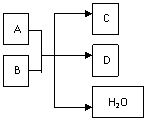
(1)若A,C,D均含有氯元素,D由三种元素组成,且A的化合价介于C与D之间,写出该反应产物D的一种用途:
 。
。
(2)若A是一种淡黄色固体,具有漂白作用,D中含有氯元素,且为融雪剂的主要成分之一,该反应的离子方程式是 。
(3)若A为一种单质,C,D均为气体且C能使澄清石灰水变浑浊,则B为 。
(4)若C是一种极易溶于水的气体,盐D是一种干燥剂,试写出检验气体C的一种方法: __
17、(9分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1)Ca元素在周期表中的位置是 ,其原子结构示意图为 。
(2)Ca与最活泼的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与Si形成的化合物E的沸点 (填高或低)
|

 □P+□FeO+□CaO □Ca3(PO4)2+□Fe
□P+□FeO+□CaO □Ca3(PO4)2+□Fe
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成绿色,最后变成褐色M(OH)n,则金属M为 ;检验Mn+的方法是 (用离子方程式表示)。
(5)取1.6g钙线试样,与水充分反应,生成224mLH2 (标准状况),再向溶液中通入适量的CO2 ,最多能得到CaCO3 g.
16、标准状况下,将aLH2和Cl2的混合气体点燃,充分反应后,将混合气体通入含bmolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测量反应后溶液中含Cl- ,ClO- ,ClO3- 。且三者物质的量之比为8:1:1,则原混合气体中H2的物质的量为( )
A、a/2 mol
B、(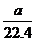 -b)mol C、
-b)mol C、 D、b/2 mol
D、b/2 mol
15、下表各组物质中,满足下图物质一步转化关系的选项是( )
|
选项 |
X |
Y |
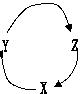 Z Z |
|
A |
Na |
NaOH |
NaHCO3 |
|
B |
Cu |
CuSO4 |
Cu(OH)2 |
|
C |
C |
CO |
CO2 |
|
D |
Si |
SiO2 |
H2
SiO3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com