
(一)氢
1、1s1有两种氧化态+1、-1。如:NaH、LiAlH4。
2、H2:高温下的还原剂。
15.(20分)某无色溶液中可能含有Na+、SO42-、SO32-、CO32-、Cl-、Cu2+、Ba2+、Br-等几种离子中的若干种,依次进行下列实验,观察到的现象如下:
①用PH试纸检验,溶液的PH大于7;②向溶液中滴加氯水无气体产生,再加入CCl4振荡,静止,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,只有白色沉淀生成,过滤;④在滤液中加入AgNO3和HNO3的混合溶液,有白色沉淀产生。
⑴原溶液中肯定有的离子是 ;肯定没有的离子是
⑵若步骤③改用BaCl2和盐酸的混合溶液,对判断⑴结论有无影响? (填“有或无”)
⑶写出步骤①溶液显碱性的化学反应方程式:
14.(15分)已知Cl2、Al2(SO4)3、CaC2、C2H5Br、CH3COCH3等物质均能与水反应。今有下列五种物质,常温下也很容易与水发生反应:
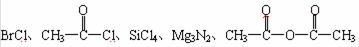
试问:
(1) 在后面所给出的五种物质与水反应的产物中,属于最高价氧化物的水化物的是 ,属于无氧酸的是 。
(2) 这五种物质放入水中,结果只生成一种产物的原物质是 。
13.(5分)浓度均为0.1mol / L的8种溶液:① HNO3 ② H2SO4 ③ HCOOH ④ Ba(OH)2 ⑤ NaOH ⑥ CH3COONa ⑦ KCl ⑧ NH4Cl,溶液pH值由小到大的顺序是:(填写编号)_________________________。
12.在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该条件的反应可能是
A pH=2的CH3COOH与pH=12的NaOH溶液等体积混合
B.0.1 mol/L的CH3COOH溶液与0.2 mol/L的NaOH溶液等体积混合
C.CH3COOH与NaOH溶液混合后所得溶液的pH=7
D.0.1 mol/L的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合
11.下列各种情况下,溶液中可能大量存在的离子组是
A.使pH试纸呈红色的溶液中:I-、Cl-、NO3-、Na+
B.澄清透明的无色溶液中:K+、Mg2+、NO3-、MnO4-
C.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Na+、Cl-、NO3-
D.含有较多的Al3+的溶液中:K+、Ca2+、ClO-、Cl-
10.室温下,下列混合溶液中,各离子浓度的关系正确的是
A.pH=12的氨水溶液与pH=2的盐酸溶液等体积混合 c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合
c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)
C.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合 c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.浓度均为0.1mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合
c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
9.物质的量浓度相同的下列溶液中,含粒子种类最多的是
A. CaCl2 B. CH3COONa C. NH3 D. K2S
8.一定条件下CuS与稀HNO3发生反应,所得还原产物为NO,氧化产物为SO42-。现将0.06molCuS加入到50mL4.2mol/LHNO3中,充分反应之后,忽略溶液体积变化,下列说法正确的是
A.被还原的硝酸为0.16mol B.反应后溶液显酸性的原因是铜盐水解
C.反应后溶液的pH=1 D.CuS未全部参加反应
7.现有常温下的四份溶液:①0.01mol/LCH3COOH;②0.01mol/LHCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③
C.将四份溶液稀释相同倍数后,溶液的pH:③>④,②>①
D.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com