
3. 不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是( )
不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是( )
A.34S原子核内的中子数为16 B.13C和15N原子核内的质子数相差2
C.1H216O在相同条件下比1H218O更易蒸发 D.2H+的酸性比1H+的酸性更强
2.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大 小。按照“酸碱质子理论”,下列说法正确的是( )
A.2Na + 2H2O=2NaOH + H2↑是酸碱反应
B. ClO-+
H2O HClO
+ OH-是酸碱反应
HClO
+ OH-是酸碱反应
C.碱性强弱顺序:OH->ClO->CH3COO-
D.HCO3-既是酸又是碱,NH3既不是酸又不是碱
1.据最新报道,科学家发现了如下反应: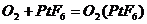 ,已知
,已知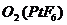 为离子化合物,其中Pt为+5价,对于此反应正确的是( )
为离子化合物,其中Pt为+5价,对于此反应正确的是( )
A.在此反应中,每生成1mol
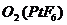 则转移1mol电子
则转移1mol电子
B.在此反应中, 是氧化剂,
是氧化剂,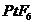 是还原剂
是还原剂
C. 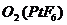 中氧元素的化合价是+1价
中氧元素的化合价是+1价
D.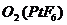 中仅存在离子键不存在共价键
中仅存在离子键不存在共价键
8.(10分) 硝酸铵在工农业生产中有重要作用,如做氮肥。
请回答下列问题:
(1)已知N2(g)
+ 3H2(g)  2NH3(g) ;ΔH=-92 kJ·mol-1。请回答:
2NH3(g) ;ΔH=-92 kJ·mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量 92.4kJ (填“<”“>”或“=”)。
②为有效提高氢气的转化率,实际生产中宜采取的措施有 (填选项字母)
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(2) 已知铂铑合金(Pt-Rh)网未预热也会发热。写出氨催化氧化的化学方程式:
该反应的化学平衡常数的表达式K= ,当温度升高时, K值 (增大、减小、无影响),其原因是 。
(3)将H2和N2按3:1的体积比混合于一定温度和压强的密闭容器中,当该反应达到平衡时,测得平衡混合气的平均式量为10,此时N2的转化率为 。
7.(10分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
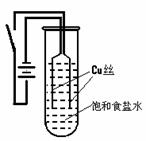 [实验1]:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。
[实验1]:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。
[实验2]:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
|
序号 |
操 作 |
现 象 |
|
① |
滴入稀硝酸溶液 |
沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
|
② |
滴入稀硫酸溶液 |
橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
[有关资料]常见铜的化合物颜色如下:
|
物质 |
颜
色 |
物质 |
颜 色 |
|
氯化铜 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
氢氧化亚铜 (不稳定) |
橙黄色 |
|
碱式氯化铜 |
绿色 |
氢氧化铜 |
蓝色 |
|
氧化亚铜 |
砖红色或橙黄色 |
氯化亚铜 |
白色 |
请回答下列问题:
(1)铜的常见正化合价为 、 ,最终试管底部橙黄色沉淀的化学式
(2)阴极上发生的反应为:
阳极上发生的反应为:
(3)写出实验2中①、②的离子方程式
①
②

6.(15分)已知X、Y、Z、W是短周期元素中的四种非金属元素,它们的原子序数依次增大。X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出元素符号:Y Z W
(2)在一定条件下,由X单质与Z单质反应生成1molE放出的热量为46.2kJ,写出该反应的热化学方程式: ;E在催化剂存在的条件下,可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效化肥,但长期施用会使土壤酸化,有关的离子方程式为 ;由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为 。
(4)工业上可用E的浓溶液来检验输送氯气的管道是否漏气,若漏气时可观察到大量白烟,同时有单质Z生成,写出相应的化学方程式: 。该反应中被氧化的E与参与反应的E的质量之比为 。

5.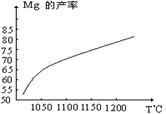
 (10分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如上图:
(10分)金属镁和镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3•MgCO3)为原料,经高温煅烧生成氧化物(CaO•MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷聚为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如上图:
⑴在冶炼过程中反应温度对生成金属镁
的影响如图,从图中分析,还原反应的
反应热△H 0(填“<”、“>” 或“=”)
理由是 。
⑵还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
⑶含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl•MgCl2• 6H2O),其中
KCl•MgCl2• 6H2O属于 (填后列的选项字母):A.复盐 B.混合物 C.配合物
⑷写出下列反应的方程式
①煅烧白云石 。
②CaO•MgO与Si的反应 。
4.(10分)已知Br2、Fe2(SO4)3、CaC2等物质均能与水发生反应,生成两种物质。下表中所列四种物质都易与水反应。
(1)在表中空格处填写各物质分别与水反应的产物中,属于氧化物对应水化物的化学式:
|
Li3N |
ClF |
NaNH2 |
SiBr4 |
|
|
|
|
|
(2)写出这四种物质与水反应的产物中,溶于水中形成的无氧酸的化学式 。
(3)写出等物质的量这四种物质分别与水反应时,耗水量最少且产物溶于水所形成的溶液显碱性,则该产物的电子式为 。
3.(14分)茶是潮汕人民最离不开的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6-7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 、 等仪器。
步骤2中,改用试剂 (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ,被滴定的20 mL滤液中含CO32-的物质的量为 mol,试计算原500g茶叶中钙离子的质量分数为 ,计算过程如下:
2.(8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是:
Mg(OH)2(固) 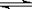 Mg2++2OH-……①
Mg2++2OH-……①
NH4++H2O
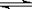 NH3·H2O+H+……
②
NH3·H2O+H+……
②
H+ + OH-
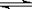 H2O…………………③
H2O…………………③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(固) 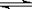 Mg2++2OH-……①
Mg2++2OH-……①
NH4++OH-
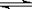 NH3·H2O…………②
NH3·H2O…………②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由
。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com