
4.提纯下列物质的方法正确的是B
①乙醇中混有苯酚(氢氧化钠溶液,蒸馏)②二氧化硅混有碘(加热)⑨硝酸钾中混有氯
化钠(溶解,蒸发,结晶)④氢氧化铁胶体中混有氯化钠(过滤)⑤生石灰中混有石灰石
(溶解,过滤)⑥乙酸乙酯中混有乙酸溶液(饱和碳酸钠溶液,分液)⑦食盐中混有氯化铵(加热)⑧高级脂肪酸钠溶液中混有丙三醇(盐析,过滤)
A.②③④⑤⑥⑦ B.①②③⑥⑦⑧ C.①②③⑤⑥⑧ D. ②③④⑥⑦⑧
3.下列叙述不正确的是C
A.根据金属活动性顺序表,可以推断冶炼金属时可能的方法
B.根据元素周期表中元素的位置,可以寻找合适的半导体材料
C.根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量
D.根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行
2.化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是D
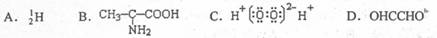
1、北京奥运会游泳馆称为美丽“水立方”,其设计灵感来自有机细胞的天然图和肥皂泡的形成。在这个中心的蓝色气泡墙中,钢结构的基本单元是一个由12个正五边形和2个正六边形所组成的几何细胞。覆盖这个框架的是半透明的气泡称为PTFE膜(聚四氟乙烯),她能为馆内带来更多自然光。根据以上信息,下列说法中 不 正确的是C
A.若设想将一个结构单元的钢棍焊成足球形成“碳笼”,它与C24 形状相似
B.若设想将一个结构单元的钢棍焊成足球形状“碳笼”,需钢棍36根(化学键)
C. PTFE 在空气中易被O2氧化
D. PTFE 的单体是 CF2 = CF2
2.下列元素中,化学性质和物理性质最像Q元素的是
A 硼(1s22s22p1) B 铍(1s22s2) C 锂(1s22s1)
D 氢(1s1) E 氦(1s2)
解析:R、U的最外层电子数均为1,R和U最可能处于同一族;Q第一电离能很大,可能为0族元素
答案:E E
①原子半径由大到小;
②主要化合价:正价由+1→+7,负价由-4→-1;
③元素性质:同一周期由前往后金属性 ,非金属性 ,同一主族,由上往下金属性 ,非金属性 ;
④电离能: 态电 性基态原子失去 个电子,转化为气态基态正离子所需要的 叫做第一电离能。第一电离能越大,金属活动性越 。同一元素的第二电离能 第一电离能;同一主族,由上往下第一电离能 ,同一周期由前往后电离有 的趋势,但二、三周期中 、 、 和 四种元素的原子第一电离能大于相邻的前后元素的原子,这是因为
⑤电负性:电负性用来描述 ,电负性的大小也可作为 的尺度,在元素周期表中,电负性最大的是 ,金属的电负性一般 1.8;同一周期由前往后电负性 ,同一主族,由上往下电负性 。
试题枚举
[例1]x 、 y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
A. x的原子半径大于y的原子半径。 B. x的电负性大于y的电负性。
C. x 的氧化性大于y的氧化性。 D. x的第一电离能大于y 的第一电离能。
解析:x的阴离子与y的阳离子具有相同的电子层结构,则y原子比x原子多一个电子层,y原子半径大,A项错误;x是非金属,y是金属,非金属的电负性大于金属,B项正确;y单质无氧化性,C错误;x是非金属,y是金属,非金属的第一电离能大于金属,D错误。
答案:B。
[例2]1、某元素的电离能(电子伏特)如下:
|
I1 |
I2 |
I3 |
I4 |
I5 |
I6 |
I7 |
|
14.5 |
29.6 |
47.4 |
77.5 |
97.9 |
551.9 |
666.8 |
此元素位于元素周期表的族数是
A. IA B. ⅡA C. ⅢA D、ⅣA E、ⅥA F、ⅤA G、 ⅦA
解析:由I5→I6电离能发生突跃,可知该元素的原子外层有5个电子。
答案:E。
[例3]应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性,②Tl能与盐酸和NaOH溶液作用均产生氢气,③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸,④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱,⑤SrSO4是难溶于水的白色固体,⑥H2Se是无色,有毒,比H2S稳定的气体
A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤
解析:由对角线规律可知Be的化合物性质与Al的化合物性质相似,①对;Tl与Al同一族,金属性比铝强很多,能与盐酸产生氢气,但不能和NaOH溶液作用,②错;卤化银颜色由上往下加深,溶解度减小,③对;Li在氧气中燃烧,产物是Li2O,④错;筛选可知
答案:C
[例4]气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
A. 1s22s22p63s23p2→1s22s22p63s23p1
B. 1s22s22p63s23p3→1s22s22p63s23p2
C. 1s22s22p63s23p4→1s22s22p63s23p3
D. 1s22s22p63s23p64s24p2→1s22s22p63s23p64s24p1
解析:题中A、B、C、D依次为Si、P、S、Ge ;Si和Ge同一族,Si在Ge上方,第一电离能大;Si、P、S为同一周期相邻元素,P的3p轨道半充满,电子能量较低,第一电离能大。
答案:B
[例5] 12.下列是几种原子的基态电子排布,电负性最大的原子是
A.1s22s22p4 B.1s22s22p63s23p3
C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
解析:题中A、B、C、D依次为O、P、Si、Ga ;O的非金属性最强,电负性最大
答案:A
[例6]根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
1.在周期表中,最可能处于同一族的是
A Q和R B S和T C T和U D R和T E R和U
3.元素周期律在周期表中的具体体现
知识梳理
元素周期律
元素的性质随着 的递增而呈周期性变化,这一规律叫做元素律,元素性质的周期性变化的本质原因是 。
2.电离能、电负性及其周期性变化
1.原子核外电子排布、原子半径、元素主要化合价、元素金属性和非金属性的周期性变化
4.指导人们在一定区域内寻找制备新物质。
试题枚举
[例1]下列关于稀有气体的叙述不正确的是
A.原子的最外层电子数都是8个电子
B.其原子与同周期IA、IIB族阳离子具有相同的核外电子排布
C.化学性质非常不活泼
D.原子半径比同周期VIIA族元素原子的大
解析:稀有气体是零族元素,解题时首先归纳它们的结构及其有关性质的特点。它们原子的特征是最外层电子都达到稳定结构(除He外最外层2个电子外,其余都是8个电子的稳定结构),故A错误。其其原子与下一周期IA、IIB族阳离子具有相同的核外电子排布,故B错误。由于最外层电子达到稳定结构,因此化学性质非常不活泼,C正确。它们的原子半径比同周期VIIA族元素原子的大,在D正确。
答案: AB
[例2]已知短周期元素的离子aA2+, bB+, cC3-, dD-都具有相同的电子层结构,下列叙述正确的是
A.原子半径A>B>D>C
B.原子序数d>c>b>a
C.离子半径 C>D>B>A
D.单质的还原性A>B>D>C
解析:短周期元素原子形成的离子都具有稀有气体原子的结构,其中阳离子与上一周期稀有气体原子的结构相同,阴离子与同一周期稀有气体原子的结构相同,再根据离子所带电荷数,可确定原子序数为a > b >d>c,B项错误;根据原子半径的递变规律知它们的原子半径为B > A > C > D,A项错误;电子层结构相同的离子半径随核电荷数的增加而减小,C正确;A、B是金属,A排在B的后面,B的还原性强,D错误。
答案:C
[例3]已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中正确的是
A.铍的原子半径大于硼的原子半径
B.氯化铍分子中铍的最外层电子数是8
C.氢氧化铍碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气
解析:铍和硼在同一周期,铍排在硼前面,半径大,A正确;氯化铍分子中铍的最外层电子数应为2,B错;铍和钙在同一族,铍在上面,金属性弱,对应氢氢化物碱性弱,C正确;铍和镁在同一族,铍在上面,金属性弱,与冷水更难反应。
解答:A C
[例4]A、B、C三种元素具有相同的电子层数,它们相同物质的量的原子获得相同物质的量的电子时释放出的能量是A>C>B,则它们的原子序数大小顺序是
A.B>C>A B.B>A>C
C.A>B>C D.A>C>B
解析:某元素的原子非金属性越强,越易得到电子,得到电子后释放的能量也多,由题中所给信息知,A、B、C是同周期元素,且非金属性A>C>B,
答案 D
[例5]A、B、C是周期表中相邻的三种元素,其中A、B同周期,B、C同主族,此三种元素原子最外层电子数之和为17,质子数之和为31,则A、B、C分别为 、 、 。

 解析:A、B、C在周期表中的位置可能有以下4种排列方式:
解析:A、B、C在周期表中的位置可能有以下4种排列方式:
 C
C
A B
B A
C
C
A B
B A
A B B A C C
① ② ③ ④
质子数之和为31,由4种排列方式可知,A、B、C只能分布在2、3周期,B、C原子序数之差为8,设B质子数为x讨论即可。
答案:N O S
元素周期律
考点聚焦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com