
13.(1)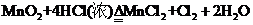
 (2)
(2)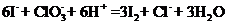
 (3)
(3)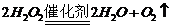 或
或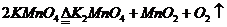
 (4)
(4)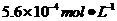
12.(1)防止浓缩时I2的挥发 (2)2FeCl3+2NaI=2FeCl2+I2↓+2NaCl
(3)加热 萃取 (4)CCl4的密度比水大 太空中没有重力作用
(5)蒸馏
0.015 mol/L×18.00mL×l0-3L/mL××214g/mL××103mg/g==45mg。该食盐合格。
11.(1)B (2) ①5:1 ②KIO3→6Na2S2O3 含KIO3:
13.(09海南 )
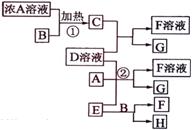
) 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
 请回答下列问题:
请回答下列问题:
 (1)反应①的化学方程式为
(1)反应①的化学方程式为
 (2)反应②的离子方程式为
(2)反应②的离子方程式为
 (3)写出另外一种实验室制取H的化学方程式
(3)写出另外一种实验室制取H的化学方程式
★ (4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
★14.海水中溴常以NaBr形式存在,经分析海水中含溴0.07%,则海水中含NaBr的质量百分含量为 _________。从海水中提取溴的方法之一是:
(1)通入Cl2至浓缩的溴化物溶液,然后用空气把生成的溴吹出。
(2)用Na2CO3溶液吸收溴(其中有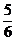 的溴的物质的量转化为Br-),同时放出CO2。
的溴的物质的量转化为Br-),同时放出CO2。
(3)向所得含溴化合物溶液中加稀H2SO4,溴又重新析出。
(4)得到的溴中可能夹杂少量的Cl2,再加入FeBr2除去
第一步反应的离子方程式 ____________________________________
第二步反应的化学方程式 ______________________________________
第三步反应中氧化剂的化学式是 ___________________
感悟高考:1、B、2、B
例1:CD 例2:2I-+2H++2ClO-=I2+2Cl-+H2O;Na2SO3和I2反应, SO32-+I2+H2O= SO42-+2I-+2H+;ClO->I2>SO32- 例3:BCF 例4:略 例5:B
课时作业:
1-10 A、D、AB 、A 、B、D、D、B、B、C
12.含I2及I-的废液中回收碘的步骤如下图所示:
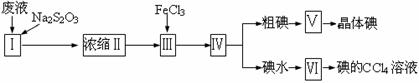
(1)浓缩前加入Na2S2O3使I2还原为I-,其目的是 。
(2)第Ⅲ步操作中发生反应的化学方程式为 。
(3)第Ⅴ步实验操作的名称是 ,第Ⅵ步操作的名称是 。
(4)碘水中加入CCl4后,充分混合后静置分层,CCl4在下层,这是因为 ;如果在太空实验室中混合这两种液体,CCl4就未必在下层,因为 。
 (5)碘的CCl4溶液通过
方法可使碘和CCl4分离。
(5)碘的CCl4溶液通过
方法可使碘和CCl4分离。
11.2003年10月,国家质检总局对全国部分城市食用盐作了抽查,合格率仅为66.7%,不合格主要原因是碘含量不足。
(1)食盐中碘主要存在于______中 A.I2 B.KIO3 C.KI D.NaIO3
(2)国家规定每千克食盐中含有该含碘物质为40-50mg为合格。为检验某碘盐是否合格,某同学称取食盐215g,溶解、酸化、加淀粉及足量的另一种含碘物质,充分反应后溶液呈蓝色,再加0.015mol·L-1的硫代硫酸钠溶液滴定,用去18.mL时,蓝色刚好褪去。有关反应如下: IO3-+5I-+6H+=3I2+3H2O I2+2S2O32-=2I-+S4O62-
请回答:①在第一个反应中,被氧化的碘与被还原的碘的质量比为________________。
②通过计算判断碘盐是否合格?
10.有一种碘和氧的化合物可以称为碘酸碘,其中碘元素呈+3价、+5价两种价态,这种化合物的化学式和应当具有的性质是
A.I2O4 强氧化性 B.I3O5 强还原性 C.I4O9 强氧化性 D.I4O7 强还原性
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
9.甲、乙、丙三种溶液各含有一种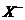 (
(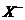 为
为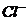 、
、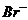 或
或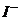 )离子,向甲中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙,颜色无明显变化。则甲、乙、丙依次含
)离子,向甲中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙,颜色无明显变化。则甲、乙、丙依次含
A.
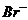 、
、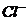 、
、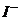 B.
B.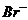 、
、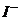 、
、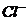 C.
C.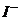 、
、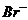 、
、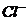 D.
D.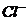 、
、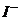 、
、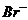
8.实验室保存下列试剂,有错误的是
A.浓盐酸易挥发,盛在无色密封的玻璃瓶中
B.碘易升华,保存在盛有水的棕色试剂瓶中
C.液溴易挥发,盛放在用水密封的用玻璃塞塞紧的棕色试剂瓶中
D.溴化银保存在棕色瓶中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com