
10.(2009·天津)下列叙述正确的是 ( )
A.0.1 mol/L C6H5ONa溶液中:c(Na+)>c(C6H5O-)> c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
解析:A中溶液显碱性c(H+)<c(OH-);B中温度不变KW不变;C中pH相等,而pH=-lgc(H+),故c(H+)相等。
答案:D
9.(2008·山东高考题)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是 ( )
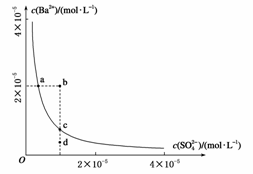
提示:BaSO4(s)Ba2+(aq)+SO2-4(aq)的平衡
常数Ksp=c(Ba2+)c(SO2-4),称为溶度积常数
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
解析:Ksp是一温度常数,改变浓度对Ksp无影响,并且线上的每一点所表示的Ksp相同,由于d点时Qc<Ksp,故无沉淀产生。
答案:C
8.已知25℃时,电离常数是Kb(NH3·H2O)=1.8×10-5,溶度积常数Ksp[Mg(OH)2]=1.8×10-11。现向1 L 1mol·L-1NH3·H2O溶液中加入1 L 0.2 mol·L-1 MgCl2溶液,则下列说法中,正确的是 ( )
A.25℃时,用pH计测得0.5 mol·L-1氨水溶液的pH=11.5
B.Ksp[Mg(OH)2]随浓度的增大而增大
C.该体系中Ksp[Mg(OH)2]=
D.该体系中没有Mg(OH)2沉淀产生
答案:A
7.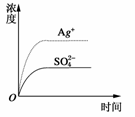 (2008·广东高考)已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO浓度随时间变化关系发右图(饱和Ag2SO4溶液中c(Ag+)=0.034
mol·L-1)。若t1时刻在上述体系中加入100 mL0.020 mol·L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO浓度随时间变化关系的是 ( )
(2008·广东高考)已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO浓度随时间变化关系发右图(饱和Ag2SO4溶液中c(Ag+)=0.034
mol·L-1)。若t1时刻在上述体系中加入100 mL0.020 mol·L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO浓度随时间变化关系的是 ( )
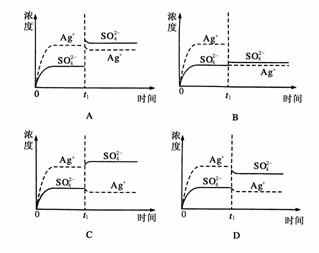
答案:B
6.(2009·板浦模拟)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的溶度积。已知下表数据:
|
物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时 的pH范围 |
≥9.6 |
≥6.4 |
3-4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是 ( )
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5?4
C.向该溶液中加入适量氯水,并调节pH到3-4后过滤,可获得纯净的CuSO4溶液
D.在pH=5的溶液中Fe3+不能大量存在
答案:C
5.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)。
下列说法正确的是 ( )
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
答案:C
4.(2009·山东师大附中模拟)将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是 ( )
①20 mL 0.01 mol·L-1 KCl 溶液 ②30 mL 0.02 mol·L-1CaCl2溶液 ③40 mL 0.03 mol·L-1 HCl溶液 ④10 mL蒸馏水 ⑤50 mL 0.05 mol·L-1AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
解析:AgCl(s)Ag+(aq)+Cl-(aq),由c(Ag+)·c(Cl-)=Ksp,c(Cl-)或c(Ag+)越大,越能抑制AgCl的溶解,AgCl的溶解度就越小。①中c(Cl-)=0.01
mol/L ②中c(Cl-)=0.04
mol/L ③中c(Cl-)=0.03
mol/L ④中c(Cl-)=0 ⑤中c(Ag+)=0.05
mol/L。Ag+或Cl-浓度由小到大的顺序为:④<①<③<②<⑤,故AgCl的溶解度由大到小的顺序为:④>①>③>②>⑤ 。
。
答案:B
3.下表是五种银盐的溶度积常数(25℃):
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
5.4×10-13 |
8.3×10-17 |
下列说法不正确的是 ( )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
答案:C
2.有关AgCl沉淀的溶解平衡的说法中,不正确的是 ( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
答案:B
1.下列说法正确的是 ( )
A.硫酸钡放入水中不导电,则硫酸钡是非电解质
B.物质溶于水达到饱和时,溶解过程就停止了
C.绝对不溶解的物质是不存在的
D.某离子被沉淀完全是指该离子在溶液中的浓度为0
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com