
17、对于mA(气)+nB(气) ? pC(气)+ qD(气)的平衡体系,当升高温度时,体系的平均分子量对氢气的相对密度从16.5变成16.9,则下列说法正确的是
? pC(气)+ qD(气)的平衡体系,当升高温度时,体系的平均分子量对氢气的相对密度从16.5变成16.9,则下列说法正确的是
A、 m+n>p+q 正反应是放热反应 B 、m+n>p+q 正反应是吸热反应
C 、m+n<p+q 逆反应是放热反应 D 、m+n<p+q 逆反应是吸热反应
16、把3molA和2.5molB混合盛入容积为2L的容器内,使它们发生反应:
3A(气)+B(气) ?xC(气)+2D(气)
?xC(气)+2D(气)
经过5min后达到平衡生成1mol D , 测得C的平均生成速率为0.10mol·L-1·min-1 。下列叙述正确的是
A、A的平均消耗速率为0.32mol·L-1·min-1 B、B的转化率为80%
C、x的值为2 D、B的平衡浓度为2mol·L-1
15、下列事实中,不能用勒沙特列原理来解释的是
A.加入催化剂有利于合成氨的反应
B.使氢硫酸中加碱有利于S2-离子增多 C.500℃左右比室温更有利于合成氨反应 D.高压条件有利于合成氨反应
14、一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成H2的总量,可向反应中加入适量的
A、NaCl(aq) B、CH3COONa(s) C、NH4Cl(s) D、Na2CO3(s)
13、.对于可逆反应 2AB3(g)  A2(g) + 3B2(g) - Q,下列图像正确的是
A2(g) + 3B2(g) - Q,下列图像正确的是



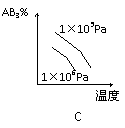
12、 .如图是表示:2X(s)+ Y(g)
.如图是表示:2X(s)+ Y(g)  ? Z(s) + R(g) + Q的气体反应速率(v)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
? Z(s) + R(g) + Q的气体反应速率(v)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
A.减少Z物质 B.加大压强
C.升高温度 D.使用催化剂
11、在1L密闭容器中通入2mol氨气,在一定温度下发生反应;2NH3 ? N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是
N2+3H2,达平衡时,N2的物质的量分数为a %,维持容器的体积和温度不变,分别通入下列几组物质,达到平衡时,容器内N2的物质的量分数仍为a %的是
A.3mol H2和1mol N2 B.4mol NH3
B.2mol N2和6mol H2 D.0.1mol NH3、0.95mol N2、2.85mol H2
10、在一定温度下,可逆反应A(g)+3B(g) ?2C(g)达到平衡状态的标志是
?2C(g)达到平衡状态的标志是
A、C生成的速率与C分解的速率相等
B、A、B、C的浓度不再变化
C、单位时间内,生成n mol A,同时生成3n mol B
D、A、B、C的分子数之比为1:3:2
9、 某密闭容器中发生如下反应:X(g)+3Y(g)
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0
2Z(g);ΔH<0
上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4-t5时间内转化率最低
8、在相同条件下(T=500K),相同体积的甲、乙两容器中,甲充入1gSO2、1gO2,乙充入2gSO2、2gO2,下列叙述中错误的是
A.化学反应速率:乙>甲 B.SO2转化率:乙>甲
C.平衡后O2浓度:乙>甲 D.平衡后SO3的体积分数:乙>甲
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com