
2. 化学反应N2+3H2 = 2NH3的能量变化如题13图所示,该反应的热化学方程式是A
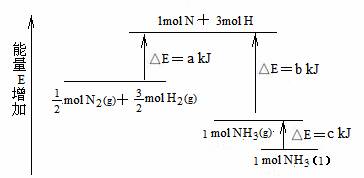
A.N2(g)+3H2(g) = 2NH3(l);⊿H = 2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g) = 2NH3(g) ;⊿H = 2(b-a)kJ·mol-1
1. 下列叙述正确的是C
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应、红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
25、在2L密闭容器中,充入1 mol N2和3mol H2,一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气中NH3的体积比为25%,求:⑴ V(H2)? ⑵ N2的转化率? ⑶ H2在平衡时的体积分数?⑷ 平衡时容器的压强与起始时压强之比?
24、在一定温度下,把4体积SO2和2体积O2通入一个有活塞的体积可变的容器中,活塞一端与大气相通(如图所示)。容器内发生下列反应:2SO2 (g)+O2(g) 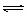 ? 2SO3(g)+热量,当反应达到平衡后,测得混合气体为5体积。
? 2SO3(g)+热量,当反应达到平衡后,测得混合气体为5体积。

(1) 保持上述温度不变,设a、b、c分别代表初始加入的SO2、O2和SO3气体的体积,如果反应过程达到平衡时,混合气体中各物质的含量仍与上述平衡相同,那么:
① 若a=1.5,c=2.5,则b= 。在此情况下,反应起始时正反应速率将 (填“大于”、“小于”或“等于”)逆反应速率。
② 若欲使起始时逆反应速率大于正反应速率,则c的取值范围为 。
(2) 在反应容器中,若起始时a、b、c值均与(1)相同,但需控制平衡时混合气体为4.5 体积,则可采取的措施是 ,原理是
。
23、在一定条件下,2NO2?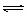 N2O4;△H<0的可逆反应达到平衡,当分别改变下列条件时,填入NO2百分含量与原百分含量的比较情况(增大、减小、不变)
N2O4;△H<0的可逆反应达到平衡,当分别改变下列条件时,填入NO2百分含量与原百分含量的比较情况(增大、减小、不变)
(1)保持容器容积不变,通入一定量NO2,则达到平衡时NO2百分含量 ,保持容器容积不变,通入一定量N2O4,则达到平衡时NO2百分含量 。
(2)保持压强不变,通入一定量NO2则达到平衡时NO2百分含量 。保持压强不变,通入一定量N2O4,则达到平衡时NO2百分含量 。
(3)保持容器容积不变,通入一定量氖气,则达到平衡时NO2转化率 ,保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时NO2转化率
22、把氮气和氢气按1:1(物质的量之比)混合均匀后分成四等份,分别充入A、B、C、D四个装有铁触媒的真空密闭容器中(容积不变),在保持相同温度的条件下,四个容器相继达到平衡状态,分析下表中的数据,回答下列问题:
|
容器代号 |
A |
B |
C |
D |
|
平衡时混合物平均式量 |
|
|
16 |
17 |
|
平衡时氮气的转化率 |
20% |
|
|
|
|
平衡时氢气的转化率 |
|
30% |
|
|
(1)平衡时,_______容器中氨气所占的比例最大.
(2) 达到平衡时反应速率最小的容器是_______ _.
(3)四个容器的压强由小到大的排列次序是____ _.
21、对于反应2A(g)
+ B(g)  2C(g)在反应过程中C的质
2C(g)在反应过程中C的质
量分数随温度变化如图所示,试确定:
(1)T0对应的V正与V逆的关系是 。
(2)正反应为 热反应。
(3)A、B两点正反应速率的大小关系 。
(4)温度T<T0时,Wc逐渐增大的原因是 。
20、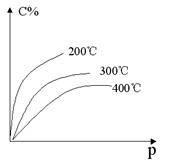 反应mA(s) + nB(g)
反应mA(s) + nB(g)  eC(g) + fD(g)反应过
eC(g) + fD(g)反应过
程中,当其它条件不变时,C的百分含量(C%)
和压强(P)的关系如图,下列叙述正确的是
A.达到平衡后,加入催化剂,则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中n>e +f
D.达到平衡后,增加A的量有利于平衡右移
江苏省黄桥中学高二化学校本练习二
19、在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g)
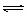 C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为c(A)·c(B)= c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5min后达平衡,各物质的平衡浓度的关系为c(A)·c(B)= c(C)·c(D)。若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
A.60% B.40% C.24% D.4%
18、在一固定容积的密闭容器中,充入3molA和1molB,发生反应:3A(g)+B(g) 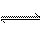 xC(g)达到平衡后,C的质量分数为ω,若在另一相同的容器和相同的温度下,按0.9molA、0.3molB和1.4molC反应达到平衡后,C的质量分数也为ω,则x的值是
xC(g)达到平衡后,C的质量分数为ω,若在另一相同的容器和相同的温度下,按0.9molA、0.3molB和1.4molC反应达到平衡后,C的质量分数也为ω,则x的值是
A.4 B.3 C.2 D.1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com