
1.已知I=A∪B={1,3,5,7,9},且A∩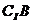 ={3,7},
={3,7},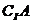 ∩B={9},则A∩B=( )
∩B={9},则A∩B=( )
(A) {1,3,7} (B) {1,5}
(C) {3,7,9} (D) {3,7}
11、(14分):⑴加成反应。 消去反应 (各1分) ⑵ HOCH2CH2CH2CHO(2分)
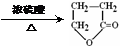 ⑶
HOCH2CH2CH2COOH
+H2O
(3分)
⑶
HOCH2CH2CH2COOH
+H2O
(3分)
 ⑷CH2=CH-CH=CH2+CH2=CH-COOH
(3分)
⑷CH2=CH-CH=CH2+CH2=CH-COOH
(3分)
⑸ CHCH2 ⑹ d (各2分)

11、 (14分)已知:CH2=CH-CH=CH2 +
CH2 = CH2
(14分)已知:CH2=CH-CH=CH2 +
CH2 = CH2
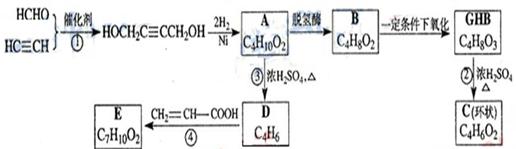 物质A在体内脱氢酶的作用下会氧化为有害物质GHB。下图是关于物质A的一种制备方法及由A引发的一系列化学反应:
物质A在体内脱氢酶的作用下会氧化为有害物质GHB。下图是关于物质A的一种制备方法及由A引发的一系列化学反应:

请回答下列问题:
⑴写出反应类型 反应① 反应③ 。
⑵写出化合物B的结构简式 。
⑶写出反应②的化学方程式 。
⑷写出反应④的化学方程式
。
⑸反应④发生过程中除生成E外,还可能产生一种含结构的副产物,这种副产物的结构简式为 。
⑹与化合物E互为同分异构体的物质不可能为 (填写字母)。
a.醇 b.醛 c.羧酸 d.酚 e.酯
10. Ⅰ(6分)(1)
Ⅰ(6分)(1)
   仪器编号 仪器编号 |
|
b |
|
d |
|
|
名称 |
|
|
|
|
|
|
改正的名称 |
|
容量瓶 |
|
酸式滴定管 |
|
(每空1分,共2分。多写或写错一处扣1分,扣完为止)
(2)①往细口容器中加液体;②组成过滤装置(只要答对两个即可,其它合理答案亦可)(每种情况1分)
Ⅱ.⑴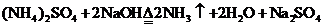 (2分)
(2分)
⑵碱石灰(1分)

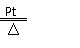 ⑶
⑶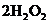
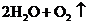 (2分)
(2分)
⑷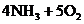
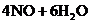 (2分)
(2分)
⑸红棕色颜色变浅(1分)
NO2(g) 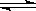 N2O4(g);△H<0,冰水冷却使平衡右移NO2浓度减小故颜色变浅(2分)
N2O4(g);△H<0,冰水冷却使平衡右移NO2浓度减小故颜色变浅(2分)
10.I(6分)某化学小组的同学到实验室学习。在实验桌上摆有下列仪器:
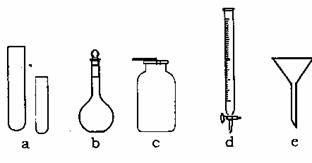
(1)指导教师要求同学们写出仪器的名称,甲同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则该空不需要填写。)
|
仪器编号 |
a |
b |
c |
d |
e |
|
名称 |
试管 |
溶量瓶 |
集气瓶 |
碱式滴定管 |
普通漏斗 |
|
改正的名称 |
|
|
|
|
|
(2)关于e的用途,乙同学说:组成防倒吸装置。你还能说出其他两种用途吗?
① ;
 ②
。
②
。
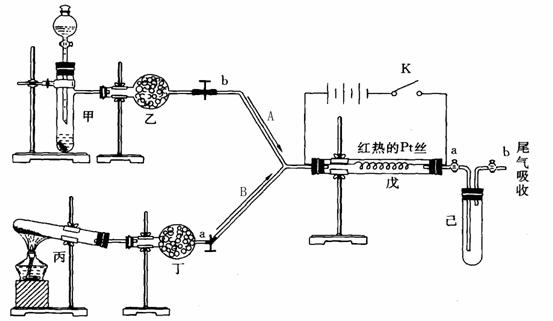 Ⅱ、(10分). 某课外小组设计了如图所示的实验装置,进行气体性质实验。图中用箭头表示气体流向,A、B分别表示两种纯净、干燥的气体。反应进行一段时间后,装置已中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取: NaHCO3,MnO2,Na2O2,NaCl,P2O5,(NH4)2SO4,碱石灰,H2O2,蒸馏水。
Ⅱ、(10分). 某课外小组设计了如图所示的实验装置,进行气体性质实验。图中用箭头表示气体流向,A、B分别表示两种纯净、干燥的气体。反应进行一段时间后,装置已中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取: NaHCO3,MnO2,Na2O2,NaCl,P2O5,(NH4)2SO4,碱石灰,H2O2,蒸馏水。
根据图中装置和反应现象请回答:
⑴丙中发生反应化学方程式为 。
⑵丁中的干燥剂应选 。
⑶甲中发生反应的化学方程式为 。
⑷戊中发生的主要反应的化学方程式为 ,
⑸当已中充满红棕色气体后,停止给丙加热,并关闭a,b活塞。取下已装置并浸入冰水中,则已中会出现的现象是 ,简述产生此现象的原因 。
9.共13分。
I.
 (2分)
(2分)
II.2NH4Cl+Ca(OH)2 △\s\up2 (--CaCl2+2NH3↑+2H2O (1分)
III.(1)c (1分) a(1分)
(2)①75%(2分)②200(2分)
IV.(1)NH3+H2O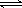 NH3·H2O
NH3·H2O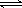 NH4++OH-(1分);
NH4++OH-(1分);
(2)室温条件下,取0.1mol/L的氯化铵溶液,滴加石蕊试剂(或用pH试纸
测定溶液pH),若溶液变红色(或pH小于7),则证明一水合氨(NH3·H2O)
是弱电解质。(2分)
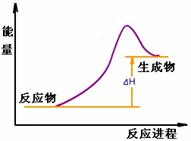
9.(13分)科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
N2(g)+3H2O(1)==2NH3(g)+O2(g) ΔH= +765.2kJ·mol-1
回答下列问题:
I.请在答题纸中画出上述反应在反应过程中体系能量变化示意图,并进行必要标注。
II.请写出实验室制取氨气的化学方程式:
III.目前工业合成氨的原理是:N2(g)+3H2(g)\s\up8(20-50MPa20-50MPa500℃、铁触媒2NH3(g);△H<0。
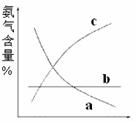 (1)右图表示随条件改变,氨气的百分含量的变化趋势。
(1)右图表示随条件改变,氨气的百分含量的变化趋势。
当横坐标为压强时,变化趋势正确的是(选填字母序
号,下同) ,当横坐标为温度时,变化趋
势正确的是 。
(2)在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60 mol H2(g),反应在一定 条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中各物质的物质的量之和的比)为。计算:
① 该条件下H2的平衡转化率为 ;
② 该条件下反应N2(g)+3H2(g)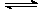 2NH3(g)的平衡常数K=
。
2NH3(g)的平衡常数K=
。
IV.(1)常温下氨气极易溶于水,其水溶液可以导电。请用方程式表示氨气溶于水且显弱碱性的过程: ;
(2)请你设计一个最简单可行的实验证明一水合氨(NH3·H2O)是弱电解质。
8. (13分)
(1) (2分)
(2分)
(2)①煮沸 (1分)
②负(1分):生成白色沉淀(1分):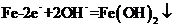 (2分)
(2分)
(3)FeaOb (3分)
8.(13分)M、R都是生括中常见的金属单质,其中R是用量最多的金属。甲、乙是化合物,其中甲是黑色晶体,可由R在X中燃烧得到。
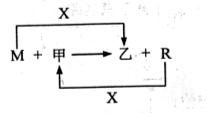
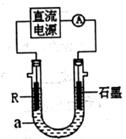 (1)
M与甲在高温下反应的化学方程式是
。
(1)
M与甲在高温下反应的化学方程式是
。
(2) 电解法制R低价氢氧化物的装置如图。a是4mol·L-1NaCl、1mol·L-1NaOH的混合溶液。
① 配制a时需要除去蒸馏水中溶解的O2,常采用
的方法。
② 石墨电极应与电源的 (填“正”或“负”)极相连接,通电后,R电极附近的现象是 ,R极的电极反应式是 .
③ 停止实验一段时间后,在R极上部有红褐色物质产生,反应的化学方程式是 。
(3) 把R的某氧化物粉末与M粉末混合后分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是a:b,则R的氧化物的化学式是 。
7.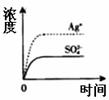 已知Ag2SO4的KSP 为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol·L-1)。若t1时刻在上述体系中加入100mL 0.020mol·L-1
Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是
B
已知Ag2SO4的KSP 为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol·L-1)。若t1时刻在上述体系中加入100mL 0.020mol·L-1
Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是
B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com